iPS Stammzell-Transplantation an der Netzhaut
Projekt-Zusammenfassung
Ziel dieses Europäischen Forschungsverbunds ist die Etablierung einer neuen Methode zur Transplantation konfluenter induzierter pluripotenter Stammzellen (iPS) auf einer Trägermatrix sowie der dazugehörige Aufbau und Logistik einer Biobank von speziell charakterisierten und mit einer neuen Methode kryokonservierten Stammzelllinien.
Wussten Sie schon?
Optische Reize werden von der Netzhaut aufgenommen und durch den Nervus Optikus zu den primären und sekundären optischen Zentren des Zentralnervensystems weitergeleitet. Die Netzhaut reicht vom Sehnervenkopf bis zur Ora serrata. Nur an diesen beiden Stellen ist sie fest mit der Unterlage verbunden. Bei der mikroskopischen Untersuchung erkennt man in der sensorischen Netzhaut acht Schichten sowie das Pigmentepithel und die Bruchsche Membran. Die Macula lutea (gelber Fleck) ist ein speziell differenziertes kreisförmiges Netzhautareal. Es reicht temporal von der Papille im horizontalen Meridian bis ca. 5,5 mm nach temporal. Eine Besonderheit stellt auch die Vaskularisation der zentralen Retina dar. Eine doppelte Gefäßversorgung sichert den außerordentlich lebhaften retinalen Stoffwechsel. Sowohl der retinale als auch der chorioidale Kreislauf können Ursprung pathologischer Prozesse sein. Die Avaskularitat der Foveola wird augenscheinlich kompensiert durch Reichtum von Ziliararterien, die in die Aderhaut hinter der Makula eintreten. Das retinale Pigmentepithel zeichnet sich durch eine eindrucksvolle Reaktionsfähigkeit aus. Sie reicht von der permanenten Phagozytose der nachwachsenden Rezeptorspitzen bis zur fibrösen "Pseudometaplasie".
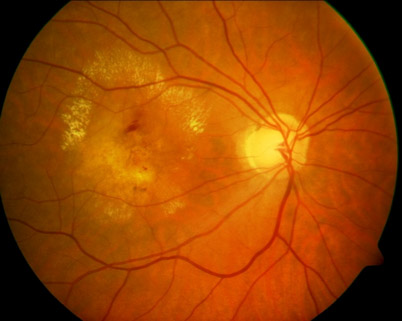 Klinischer Hintergrund
Klinischer Hintergrund
Ein funktionierendes Retinales Pigmentepithel (RPE) ist Grundvoraussetzung zur Erhaltung der äußeren neuralen Retina und Choriokapillaris. Pathophysiologische, aber auch altersbedingte Veränderungen des RPE können vielerlei Konsequenzen für umliegende Strukturen nach sich ziehen, beispielsweise für die Bruch’sche Membran (BM), die Choriokapillaris, die Photorezeptoren oder die extrazelluläre Matrix. Diese tragen infolge zur Pathogenese multipler Visusbeeinträchtigungen bei, u.a. auch zur Altersbedingten Makuladegeneration (AMD). Sie ist die häufigste Erblindungsursache in den Industriestaaten. Ca. 8,7 % der Weltbevölkerung leiden daran. Die zurzeit verfügbaren Medikamente können AMD nur verlangsamen, nicht heilen. Eine lebenslange Therapie mit hohen Kosten und großem Aufwand ist für die Patienten nötig.
Warum sind bestehende Standardtherapien nicht ausreichend?
Die einzige Therapie, die bisher nachweislich eine AMD dauerhaft heilen kann, ist die subretinale Membranextraktion mit autologem Ersatz der retinalen Pigmentepithelzell- (RPE) Schicht. Die bisherigen Methoden (Makulatranslokation, RPE-Bruch-Aderhautpatch) zeigen jedoch eine unvertretbar hohe Komplikationsrate und haben sich deshalb nicht durchgesetzt.
Deutlich weniger Invasivität verspricht die Technik der subretinalen RPE-Transplantation. Versuche haben gezeigt, dass eine subretinale Transplantation von retinalen Pigmentepithelzellen (RPE-Zellen) die Funktionen der Retina deutlich verbessert. Erste Langzeitstudien an AMD-Patienten, bei denen autologe RPE-Zellen aus peripheren Arealen isoliert, ex-vivo aufkonzentriert und wieder subretinal unter die Makula injiziert wurden, zeigen ebenfalls die Unbedenklichkeit und eine Verbesserung des Visus. Allerdings ist dieser Ansatz limitiert durch:
- Geringe Polarität der sedimentierten Zellen
- Keine Ausbildung eines konfluenten Zellrasens
- Eine autologe Transplantation in AMD-Patienten behält die genetische Disposition für AMD bei. In der Praxis zeigen Patienten mit Aderhautpatch eine erneute Ausbildung areolärer Atrophie-Areale.
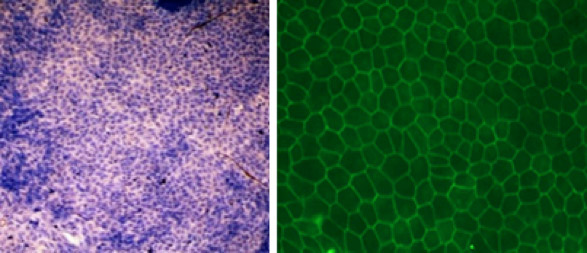
Konfluent kultivierte Stammzellen zur Behandlung der Makuladegeneration
Zielsetzung
Ziel dieses Projektes ist die Etablierung einer neuen Methode zur Transplantation konfluenter induzierter pluripotenter Stammzellen (iPS) auf einer Trägermatrix. Dazu werden iPS-Zelllinien zunächst charakterisiert und zur Konfluenz gebracht. Anschließend werden sie zu RPE-Zellen redifferenziert und auf einer Trägermatrix bis zur Konfluenz kultiviert. Der charakterisierte iPS-RPE-Patch wird unter die Netzhaut transplantiert. Ziel des Europäischen Forschungsverbunds ist die Etablierung von speziell charakterisierten Zelllinien und mit einer neuen Methodik kryokonservierten Stammzelllinien in einer Kryobank. Der Versand eines individualisierten iPS-RPE-Patches an die transplantierende Klinik erfolgt in einer lückenlosen Kühlkette, so dass das Transplantat direkt vor der Operation aufgetaut und sich nativ ohne Funktionsverlust transplantieren lässt. Dazu wird eine neue endoskopische Operationstechnik zur minimal-invasiven Transplantation dieser iPS-RPE-Patches entwickelt.
Wie ist der Projektstand?
Das Vorhaben gewinnt durch die Expertise von international anerkannten Kooperationspartnern an Bedeutsamkeit und befindet sich aktuell im Verfahren um ein positives BMBF-Votum.
Das Projektteam
PD Dr. Dr. med. Boris Stanzel (Arbeitsgruppenleiter)
Dr. med. Annekatrin Rickmann
Dr. rer. nat. Silke Wahl
Prof. Dr. med. Peter Szurman
Weitwinkel-Retina-Implantat
Projekt-Zusammenfassung
Ziel ist die Entwicklung von minimal-invasiven Retina-Implantaten (Netzhautchip) zur Wiedererlangung eines orientierenden Sehens bei vollständig erblindeten Patienten. Unsere Retinaprothese verfolgt einen ganz neuen technologischen Ansatz.
Wussten Sie schon?
Erstmals soll eine Weitwinkelprojektion zur Erstellung eines natürlichen Gesichtsfelds realisiert werden. Durch die zusätzliche drahtlose opto-elektrische Signalübertragung sollen keine Drähte mehr an oder in das Auge hineinführen.
 Klinischer Hintergrund
Klinischer Hintergrund
Weltweit leiden etwa 3 Millionen Menschen an erblichen Netzhaut-Erkrankung. Bei der Retinitis pigmentosa, der häufigsten Form dieser erblichen Netzhauterkrankungen, kommt es zu einem langsamen Absterben der Photorezeptoren, was im Endstadium zur vollständigen Erblindung führen kann.
Abbildung: Patientin mit Argus II-Netzhautchip bei Rehabilitationstraining.
Warum sind bestehende Standardtherapien nicht ausreichend?
Bisherige Retina-Implantate zeigen Limitationen in Bezug auf ein sehr geringes Gesichtsfeld (<15°), einer reduzierten Auflösung (≤ 1500 Pixel), externer Energiezufuhr (transsklerale Kabellösung), oft großen extraokulare Bauteile und langer Operationszeit. Die im besten Fall erreichbare Funktion ist derzeit leider auf ein orientierendes Konturensehen innerhalb eines kleinen Gesichtsfeld-Radius beschränkt. Eine breite Anwendung wird sich aber erst ergeben, wenn für alle eine substanzielle Optimierung und Verbesserung erreicht wird.
Zielsetzung
Ziel ist die Entwicklung eines Retina-Implantats mit ganz neuem Ansatz. Dabei sollen Features wie Kabellosigkeit (keine extraokularen Bauteile außer einer Brille), eine drahtlose Energie- und Datenübertragung auf das Implantat, ein Weitwinkeleffekt zur Erstellung eines natürlichen Gesichtsfelds und eine flexible Selbstfixierung des intraokularen Implantats realisiert werden.
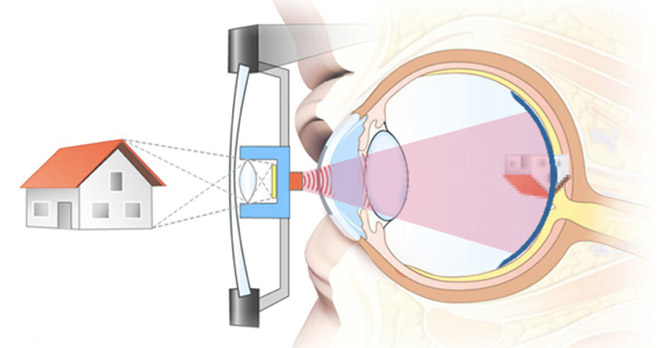
Weitwinkel-Retina-Implantat zur erstmaligen Bereitstellung eines ausreichenden Gesichtsfeld-Bereichs
Wie ist der Projektstand?
Aufbauend auf die klinische Erfahrung mit der Implantation, der klinischen Überwachung und auch der Explantation von epiretinalen und subretinalen Chips fließen diese Kompetenzen inklusive der Erfahrung in der Grundlagenforschung samt der daraus resultierender Patente bereits in die präklinischen Entwicklung dieses Chips mit ein. Durch die Kooperation mit dem Fraunhofer-Institut für Biomedizinische Technik IBMT sowie weiteren Industriepartnern streben wir nach Abschluss der Entwicklung, Validierung der Funktion und Biokompatibilität im weiteren Verlauf die klinische Überprüfung an.
Das Projektteam
Prof. Dr. med. Peter Szurman (Arbeitsgruppenleiter)
Prof. Dr. med. Kai Januschowski
Kooperationspartner
Fraunhofer-Institut für Biomedizinische Technik IBMT
Tissue Engineering
Projekt-Zusammenfassung
Ziel dieser Arbeitsgruppe ist die Entwicklung von künstlichen Geweben und Biogrenzflächen, welche sowohl das Verständnis als auch die Therapie von Augenkrankheiten mit dem Schwerpunkt vitreoretinale und korneale Krankheitsbilder fördern sollen.
Klinischer Hintergrund
In den frühen 1990er Jahren entstand mit dem Tissue Engineering (engl. für Gewebezüchtung) ein interdisziplinärer Teilbereich der regenerativen Medizin, der darauf abzielt, die Funktion eines biologischen Gewebes wiederherzustellen, zu erhalten oder zu verbessern. Durch die gezielte Kombination von Zellen und bioaktiven Stoffen (z.B. Wachstumsfaktoren) mit einem Biomaterial als strukturellem Gerüst können künstliche Gewebe entstehen, die sich nach der Implantation im menschlichen Körper integrieren und den Heilungsprozess fördern. Das Auge bietet mit seinen unterschiedlichen Strukturen, Zelltypen und Geweben eine Vielzahl Tissue-Engineering-relevanter Herausforderungen. Aufgrund altersbedingter Degenerationsprozesse und verschiedener Krankheitsverläufe kann es zu auftretenden Fehlfunktionen des okularen Gewebes mit dem Risiko von schweren Sehbehinderungen bis hin zur Erblindung kommen. Einen geeigneten Therapieansatz stellt die Transplantation von natürlichen (Teil-)Geweben oder artifiziellen Ersatzstoffen dar.
In der Augenheilkunde besteht insbesondere ein hoher Bedarf an geeigneten Ersatzmaterialien für die Hornhaut, die Linse und den Glaskörper. Bei der Hornhauttransplantation werden beschädigte oder erkrankte Hornhäute durch gespendetes Hornhautgewebe ganz (perforierende Keratoplastik) oder teilweise (lamellare Keratoplastik) ersetzt. Hinzu kommen über 20 Mio. Katarakt-Operationen weltweit, bei der die getrübte Linse abgesaugt und durch eine starre Kunstlinse ersetzt wird. Nicht zuletzt erfordert die Therapie von komplizierten Netzhaut- und Glaskörpererkrankungen das chirurgische Entfernen des natürlichen Glaskörpers (Vitrektomie) und einen geeigneten Ersatz des Gewebes.
Warum sind bestehende Standardtherapien nicht ausreichend?
Eine der größten Herausforderungen, vor der das Tissue Engineering bis heute steht, ist die notwendige komplexe Funktionalität eines Gewebes und dessen gezielte Integration in den menschlichen Körper. Die Anfänge der regenerativen Medizin zeigten, dass der Einsatz von rein synthetischen Materialien häufig mit der Gefahr von Fremdkörperreaktionen verbunden war, die zu beschwerlichem Implantat-Versagen sowie zu Entzündungs- und Abstoßungsreaktionen führten. Die gestörten Wundheilungsprozesse und Infektionen können zudem zur Ausbildung von Narben führen, die die Sehfähigkeit einschränken. Um die Verträglichkeit der Implantate zu verbessern, gewannen zunehmend Konzepte an Bedeutung, die bioaktive oder körpereigene Materialien integrierten. So sollen Biomaterialien und lebende Zellen die Biokompatibilität, Funktionalität und Stabilität des Implantats erhöhen und dessen erfolgreichen Einsatz zur Regeneration von Körperfunktionen langfristig sichern.
Trotz der medizinischen Fortschritte der letzten Jahre verdeutlichen der Anstieg der altersbedingten Erblindungen und der bestehende Mangel an Gewebespenden den Bedarf an alternativen Behandlungsmethoden. Am Beispiel der Hornhauttransplantationen ist die Zahl der geeigneten Transplantate durch Faktoren wie Vernarbungen und geringe Endothelzellzahlen, Haltbarkeit und positive virologische oder mikrobiologische Befunde der Transplantate limitiert. Bestehende Ansätze zur Entwicklung von künstlichen Hornhautgeweben sind zum einen durch die mangelnde Bioverträglichkeit, Geometrie und Stabilität der Gerüststrukturen und zum anderen durch die ungenügende Integration und Funktionalität der verschiedenen Hornhautzellen eingeschränkt. Mit Blick auf die Behandlung eines Katarakts ist zu beanstanden, dass bei einer Graue-Star-Operation zwar die Sehkraft wiederhergestellt wird, jedoch nicht die Akkomodation (Naheinstellung). Zusätzlich muss eine Vielzahl der behandelten Patienten aufgrund einer proliferierenden, trüben Zellschicht hinter dem Linsenimplantat (Nachstar) für eine zweite Operation vorstellig werden. Auch die bestehenden Ersatzstrategien für den entfernten, natürlichen Glaskörper nach Netzhaut- und Glaskörperoperationen sind durch den Einsatz von hydrophoben Ölen, Gasen oder Perfluorcarbenen unzureichend, da Komplikationen wie Emulsifikationen, Kataraktbildung und die Notwendigkeit einer zusätzlichen operativen Entfernung resultieren können.
Zielsetzung
Durch die Kombination von Zellen, Biomaterialien und bioaktiven Stoffen wie Wachstums- und Differenzierungsfaktoren sollen mit Blick auf die klinische Anwendung gezielt neue regenerative Behandlungsstrategien entwickelt werden:
- Entwicklung der weltweit ersten Tamponade für die Netzhautchirurgie auf Basis eines Hydrogels, welche die natürlichen Eigenschaften des gesunden Glaskörpers nachbildet. Der aktuelle materialbasierte Entwicklungsstand soll durch Inklusion von Zellen und/oder Zellprodukten um die Ebene des Tissue Engineerings erweitert werden.
- Entwicklung einer echten akkommodierenden Linse auf Basis eines flexiblen biokompatiblen Hydrogels, mit dem der Kapselsack nach Femtosekunden-laser-gestützter Linsenentfernung wieder aufgefüllt werden soll.
- Entwicklung eines transplantierbaren bioresorbierbaren Trägersheets mit kultivierten autologen oder hiPSC-abgeleiteten Limbusstammzellen zur Behandlung von Patienten mit Hornhautblindheit aufgrund schwerster Verbrennungen/Verätzungen.
- Entwicklung eines dreidimensionalen künstlichen Hornhautkonstrukts mit Rezellularisierung durch autologe oder hiPS-abgeleitete Hornhautzellen sowie die Optimierung der Präparations- und Kultivierungstechniken für künstliche Biomatrix-Konstrukte im Vergleich zu modifizierten Hornhaut-Spenderlamellen.
Über den Erhalt bzw. die Rückgewinnung von funktionellem Gewebe hinausgehend wird darauf abgezielt, das Risiko potentieller Abstoßungs- und Entzündungsreaktionen nach Transplantation zu reduzieren und den Therapieerfolg eines Transplantats langfristig zu sichern. Dazu ist es notwendig, die Biogrenzfläche mit ihren vielfältigen Zell-Matrix-Interaktionen in den fächerübergreifenden Fokus von Medizin, Biologie, Chemie und Materialwissenschaften zu rücken. Das Design von künstlichen Geweben und definierten Biogrenzflächen erfordert dabei ein tiefes Verständnis der komplexen Wechselwirkungen zwischen Material und Zelle, das unter Laborbedingungen außerhalb des Organismus -in-vitro- erlangt werden kann.
Wie ist der Projektstand?
Es besteht langjährige Erfahrung mit der Entwicklung biopolymerer Materialplattformen, insbesondere von Hydrogel-basierten Gerüststrukturen, sowie der Isolation, Kultivierung und Manipulation verschiedenster Zellen für das Tissue Engineering. Kritische Materialeigenschaften zur Herstellung biomimetischer Systeme wurden definiert und tiefergehend untersucht. Studien zum Einfluss der Materialoberfläche und von Proteinen auf die Biogrenzfläche lieferten Erkenntnisse zur gezielten Kontrolle und Steuerung von Zellfunktionen. In in-vitro-Studien wurden erste, vielversprechende Materialsysteme getestet, mit Zellen besiedelt und die resultierenden Zell-Matrix-Kontakte analysiert. Die Evaluation der Prototypen in-vivo wird zur Zeit weiter vorangetrieben.

- Extraktion und Präparation von Geweben
- Toxizitäts-Assays
- Synthese und Modifikation artifizieller Gerüststrukturen
- Biochemische Dezellularisierung von tierischem Gewebe
- Bestimmung physikochemischer Materialeigenschaften (Benetzbarkeit, Ladung, Rauigkeit, Topografie, Stabilität/Degradation, Porosität, rheologische und mechanische Charakteristika)
- Analyse der Proteinadsorption (Quantität, Stabilität, Faltungsprozesse)
- Zellkulturtechniken mit Adhäsions-, Proliferations-, Migrations- und Differenzierungs-Assays
- Histologische Gewebsschnitte
- Molekularbiologische Assays (qPCR)
- Immunologische Methoden (ELISA, Immunfluoreszenz, FACS, Western Blot)
- Vitreoretinale Operationseinheit (Funduskopie, OCT, Augendruckmessung)
- Elektrophysiologische Untersuchungseinheit (ERG)
Das Projektteam
Dr. rer. nat. André Schulz (Arbeitsgruppenleiter)
Dr. med. Annekatrin Rickmann
Dr. rer. nat. Silke Wahl
Dr. rer. nat. Henrike Julich-Härtel
Prof. Dr. med. Kai Januschowski
Prof. Dr. med. Peter Szurman
Kooperationspartner
Fraunhofer-Institut für Biomedizinische Technik IBMT
Schlüsselpublikationen
-
- Schulz A, Rickmann A, Wahl S, Germann A, Stanzel B V, Januschowski K, Szurman P (2020). Alginate-and hyaluronic acid–based hydrogels as vitreous substitutes: An in vitro evaluation. Transl. Vis. Sci. Techn., 9(13): 34.
- Schulz A, Rickmann A, Julich‐Haertel H, Germann A, von Briesen H, Januschowski K, Szurman P (2020). Comparative cytotoxic and antiproliferative profile of methotrexate and fluorouracil on different ocular cells. Acta Ophthalmologica.
- Schulz A, Wahl S, Rickmann A, Ludwig J, Stanzel BV, von Briesen H, Szurman P (2019): Age-related loss of human vitreal viscoelasticity. Transl. Vis. Sci. Techn., 8(3): 56.
- Schramm C, Spitzer MS, Henke-Fahle S, Steinmetz G, Januschowski K, Heiduschka P, Geis-Gerstorfer J, Biedermann T, Bartz-Schmidt KU, Szurman P (2012): The crosslinked biopolymer hyaluronic acid as an artificial vitreous substitute. Invest Ophth Vis Sci, 53 (2), 613-621.
- Schulz A, Gepp MM, Stracke F, von Briesen H, Neubauer JC, Zimmermann H (2019): Tyramine-conjugated alginate surfaces as a platform for bioactive scaffolds. J. Biomed. Mater. Res. A., 107(1): 114-121.
- Schulz A, Katsen-Globa A, Huber EJ, Mueller SC, Kreiner A, Pütz N, Gepp MM, Fischer B, Stracke F, von Briesen H, Neubauer JC, Zimmermann H (2018): Poly(amidoamine)-alginate hydrogels: Directing the behavior of mesenchymal stem cells with charged hydrogel surfaces. J. Mater. Sci. Mater. Med., 29: 105.
- Yoeruek E, Bayyoud T, Maurus C, Homann J, Spitzer MS, Bartz-Schmidt KU, Szurman P (2012): Decellularization of porcine corneas and repopulation with human corneal cells for tissue-engineered xenografts. Acta Ophthalmologica, 90(2): 125-131.
Glaskörperersatz (Artificial Vitreous)
Projekt-Zusammenfassung
Ziel dieser Arbeitsgruppe ist die Entwicklung und Optimierung eines neuartigen Glaskörperersatz auf Hydrogel-Basis, welcher genügend Festigkeit, Stabilität, Viskosität und Quelldruck aufweist, um eine ausreichende Tamponade im Glaskörperraum zu gewähren. Neben guten Tamponade-, rheologischen und optischen Eigenschaften soll das Glaskörperäquivalent gleichzeitig als Trägermatrix zur verzögerten Medikamentenfreisetzung dienen. Derzeit werden die ersten Funktionsmuster in präklinischen Studien getestet.
Wussten Sie schon?
Der Glaskörper hat ein Volumen von ca. 4 ml und wiegt ungefähr 4 g bei einer Dichte von 1,0053 g/cm3. Der Refraktionsindex beträgt 1,336. Bei einer Wellenlänge zwischen 300 und 1400 nm besteht eine Lichtdurchlässigkeit von etwa 90%. Der pH-Wert im Glaskörperraum liegt zwischen 7,3-7,5. Der menschliche Glaskörper besteht zu 98 % aus Wasser und zu 2 % aus den Makromolekülen Kollagen und Hyaluronsäure.
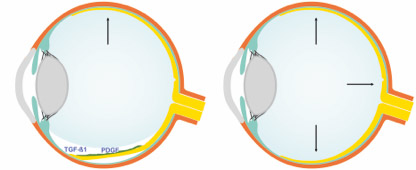
Die Tamponadewirkung von hydrophoben Endotamponaden (links) im Vergleich zum neu entwickelten Hydrogel-Glaskörperersatz (rechts). Während links keine vollständige Tamponade erreicht werden kann und sich Wachstumsfaktoren unterhalb der Tamponade konzentrieren und so proliferative Prozesse befördern, kann ein natürlicher Glaskörperersatz eine volle Tamponade erreichen und sich dennoch in die natürliche Homöostase einfügen.
Klinischer Hintergrund
Die Behandlung komplizierter Netzhaut- und Glaskörpererkrankungen ist eine der zentralen Herausforderungen in der operativen Augenheilkunde. Im Rahmen der Standardtherapie wird der natürliche Glaskörper entfernt (Vitrektomie) und die Netzhaut mit einer temporären Tamponade stabilisiert. Trotz wesentlicher technologischer Innovationen löst die pars-plana-Vitrektomie in Kombination mit Endotamponaden nicht alle Probleme der Ablatiochirurgie. Auch modernste Tamponadematerialien bieten keine zufriedenstellende Antwort auf Mehrlochsituationen an unterschiedlichen Stellen, die Problematik der proliferativen Vitreoretinopathie (PVR) oder die persistierende Hypotonie.
Warum sind bestehende Standardtherapien nicht ausreichend?
Bisherige Tamponaden sind in ihren Materialeigenschaften hydrophob (Gase, Öle, semifluorierte Alkane) und üben ihre tamponierenden Eigenschaften über Auftriebsvektor und Oberflächenspannung aus. Obwohl das in der klinischen Anwendung durchaus erfolgreich ist, birgt der hydrophobe Charakter auch deutliche Nachteile, die beispielsweise die PVR-Entwicklung eher fördern als hemmen. Hydrophobe Tamponaden sind aus folgenden Gründen in ihrer Wirkung limitiert, weil
(1) keine vollständige Tamponade erreicht werden kann,
(2) keine gleichmäßige Tamponade aller Netzhautanteile erreicht wird,
(3) PVR nicht verhindert wird.
Die Tamponade-Wirkung weicht auch völlig von den Eigenschaften des natürlichen Glaskörpers, der als Komposit-Hydrogel hydrophil ist und so eine gleichmäßige Andruckwirkung erzielt.
Zielsetzung
Wünschenswert im Sinne einer idealen Tamponade wäre ein Glaskörperersatz, der dem natürlichen Glaskörper nachempfunden ist, also seine tamponierende Wirkung eher durch Quelldruck und Viskosität ausübt. Moderne Hydrogele zeigen eine gute, Quelldruck-vermittelte Tamponadewirkung bei gleichzeitig sehr guten optischen Eigenschaften. Verschiedene Ansätze erstrecken sich vorwiegend auf den Einsatz quervernetzter semisynthetischer oder vollsynthetischer Polymere. Diese Hydrogele besitzen nicht nur ausgezeichnete refraktive und rheologische Eigenschaften sowie eine hervorragende Biokompatibilität, sondern wirken zusätzlich antiadhäsiv und antimigrativ. Dadurch ließen sich PVR Reaktionen alleine durch die Hydrogel-Tamponade reduzieren. Die zusätzliche Möglichkeit einer kontrollierten Medikamentenfreisetzung durch entsprechend beladene Hydrogele kann weitere antiproliferative, neuroprotektive oder nutritive Funktionen erfüllen.
Wie ist der Projektstand?
Im Jahr 2002 wurde ein Tissue Engineering-Labor zur Entwicklung eines künstlichen Glaskörperäquivalentes eingerichtet. Das Projekt wird seit Beginn über Stiftungszuwendungen, ein Fellowship-Projekt der Europäischen Union und der Deutschen Forschungsgemeinschaft gefördert. Über die Projektförderungen konnten wir in der Forschungsgruppe mehrere Doktoranden, Post-Doktoranden und ausländische Stipendiaten integrieren. Inzwischen wurden mehrere Glaskörper-Äquivalente auf Hydrogel-Basis (quervernetzte Glycosaminoglykane) entwickelt und als Medikamententräger zur verzögerten Freisetzung antiproliferativ wirksamer Medikamente optimiert. Wir konnten zeigen, dass unser Glaskörperersatz auf Hydrogel-Basis eine hervorragende Langzeit-Stabilität und -Verträglichkeit hat. Die neuesten Entwicklungen scheinen sogar die Kataraktprogression nach einer Vitrektomie zu verzögern. Zukünftige Entwicklungen von Hydrogel-Tamponaden werden auch die Bedeutung des Glaskörperkortex einbeziehen. Derzeit laufen die ersten präklinischen Studien unter Aufsicht der Ethikkommission Saarbrücken.

Prototypen des neuen Glaskörperersatz auf Hydrogel-Basis. Es kann über 23gauge injiziert werden und erhält sich dennoch eine ausreichende Steifigkeit für hochwertige Tamponade-Eigenschaften
Wie sind wir methodisch aufgestellt?
Zellkulturtechniken mit Proliferations- und Toxizitäts-Assays, Immunfluoreszenz-Aufarbeitung histologischer Gewebeschnitte, Antikörper-Assays, Partikelgrößenmessung, Photometrische Konzentrationsmessung in Gewebe, HPLC, Western-Blot, FACS-Analyse, Gewebepräparation mit Materialgewinnung und Zellzählung und Spezialfärbungen, in-vivo Versuche operativ mit Langzeitbeobachtung (Vitreoretinale Operationseinheit entsprechend Augen-OP, Foto, Spaltlampe, Augendruckmessung), Elektrophysiologische Untersuchungseinheit
Das Projektteam
Prof. Dr. med. Peter Szurman (Arbeitsgruppenleiter)
Prof. Dr. med. Kai Januschowski
Superfundiertes isoliertes Netzhautmodell
Projekt-Zusammenfassung
Ziel dieser Arbeitsgruppe ist die elektrophysiologische Untersuchung isolierter Retinakulturen während und nach der Umspülung mit einer Testsubstanz zur Detektion etwaig retinatoxischer Effekte. Hierzu konnten wir ein Organmodell der isolierten superfundierten Netzhautpräparaten aufbauen. Das erlaubt ein in-vivo Monitoring der Netzhautfunktion unter definierter Exposition von zu testenden Wirkstoffen über einen Zeitraum von 36 Stunden. Somit wird ein direktes Monitoring substanzspezifischer Einflüsse auf die Netzhautfunktion ermöglicht. Zusätzlich besteht eine zellbiologische Laborstruktur, die eine standardisierte Bestimmung der selektiven Medikamententoxizität an kultivierten retinalen Zelllinien erlaubt. Seit Bestehen der Arbeitsgruppe haben wir grundlegende Erkenntnisse zum medikamentösen Targeting retinaler Erkrankungen erzielt und damit die klinische Sicherheit neu eingeführter Medikamente verbessert.
Netzhaut - Anatomie & Physiologie
Die Netzhaut befindet sich im hinteren Teil des Auges, in dem die Lichtrezeptoren liegen und die ersten Informationen über das Sehen verarbeitet werden. Sie ist, wie das Gehirn, durch die sogenannte Blut-Retina-Schranke vom restlichen Organismus getrennt.
Als erste Schicht, die das Licht verarbeitet, sind die Photorezeptoren (Stäbchen und Zapfen) zu nennen. Danach schließt sich die äußere plexiforme Schicht an, in der die Fortsätze der Photorezeptoren synaptisch mit den Horizontal- und Bipolarzellen verschaltet sind, die mit den Zellkörpern der Amakrinenzellen die innere Körnerschicht bilden. Weiter nach Innen schließt sich die innere plexiforme Schicht an, in der die Synapsenkontakte der amakrinen Zellen und die der Bipolarzellen mit den Ganglienzellen zu treffen sind. Aus den Axonen der Ganglienzellen wird die Ganglienzellfaserschicht gebildet, die als Nervus opticus zur Sehrinde ziehen. Die Müllerstützzellen bilden die Lamina limitans externa und die Lamina limitans interna.
Die Reiztransduktion in der Netzhaut ist für die Wahrnehmung visueller Reize essentiell und kann zugleich durch Ableitung eines ERGs gemessen werden. Das besondere an den Sinnesrezeptoren der Retina ist, dass Sie im Ruhezustand depolarisiert und im Erregungszustand hyperpolarisiert sind.
Bei anderen neuronalen Mechanismen der Reizverarbeitung im Körper ist das Gegenteil der Fall. Diese Hyperpolarisation ist im ERG messbar.
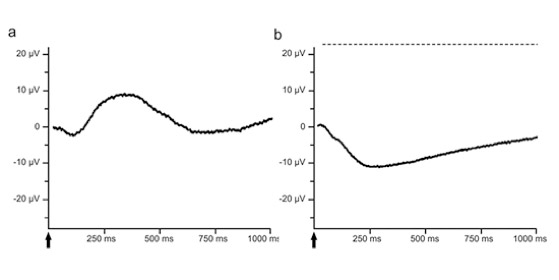
a: Antwort des Photorezeptors im zeitlichen Verlauf dargestellt. Der Lichtreiz ist durch den Pfeil markiert
b: Antwort des höheren neuronalen Netzwerkes im zeitlichen Verlauf dargestellt. Der Lichtreiz ist durch den Pfeil markiert.
Klinischer Hintergrund
Während der Behandlung von Netzhaut- und Glaskörpererkrankungen kommt die Netzhaut nach der Entfernung des natürlichen Glaskörpers (Vitrektomie) mit unterschiedlichen Substanzen in Kontakt. Je nach Krankheitsbild kann auch eine (temporäre) Endotamponade über längere Zeit nach der Operation in der Glaskörperkavität verbleibend. Hierfür müssen diese Substanzen gewisse Voraussetzungen erfüllen. Mithilfe der superfundierten Netzhaut ist es möglich eine potentielle Retinatoxizität vorab zu testen.
Warum sind bestehende Standardtherapien nicht ausreichend?
Aktuell ist es in vitro und in vivo nur leidlich möglich, eine standardisierte Beziehung zwischen Dosis, Applikationszeit und retinaler Toxizität herzustellen. Ein echter in vitro Ansatz ist derzeit aufgrund des komplexen Aufbaus der Retina und deren Störanfälligkeit sowie der fehlenden Perfusion nicht praktikabel.
Zielsetzung
Um den Einsatz von Tierversuchen zu minimieren, verfolgen wir mit der superfundierten Netzhaut einen ex-vivo Ansatz. Hierbei wird eine bovine Netzhaut mit einer Nährlösung und der zu testenden Substanz umspült und im Anschluss eine elektrophysiologische Untersuchungen durchgeführt. Je nach dem Muster der retinalen Antwort auf einen Lichtreiz kann somit auf eine mögliche Retinatoxizität der Substanz geschlossen werden.
So funktioniert das ERG (Elektroretinographie)
Das ERG wurde erstmalig 1849 von Du-Bois-Raymond am Bulbus eines enukleierten Fischauges abgeleitet. Bereits 1945 wurde das ERG klinisch nutzbar gemacht.
Heute ist es der Goldstandard zur Diagnostik bei Netzhautdegenerationserkrankungen oder -dystrophien. Bei einem ERG kann man zwei Wellenkomponenten unterscheiden, eine a-Welle (Hyperpolarisation) und eine b-Welle (Depolarisation). Die a-Welle liefert Informationen über die Funktionalität der Lichtrezeptoren der Netzhaut (Abb. a). Sie ist das durch die Photorezeptoren gebildete Summenpotential, die als erste Antwort auf einen Lichtreiz in Form eines negativen Ausschlags im ERG erscheint. Auf diesen ersten negativen Ausschlag folgt mit einer kurzen Latenz ein positiver Ausschlag, die b-Welle. Von der b-Welle im ERG zieht man Rückschlüsse auf die Funktion der höheren neuronalen Netzwerke innerhalb der Netzhaut (Abb. b). Das Zusammenspiel mehrerer Zelltypen generiert die b-Welle. Sie ist damit als Indikator für die komplexen, integrierenden Netzwerkfunktionen sehr sensibel.
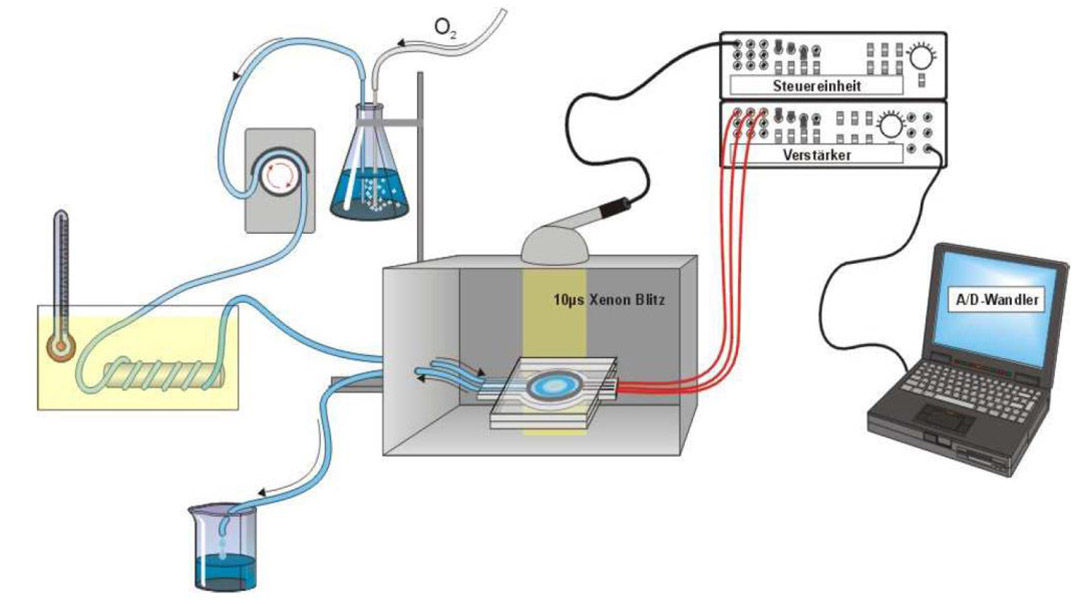
Messung der Retinalen Biokompatibilität
Durch unterschiedliche Reizintensitäten oder durch Zugabe von Aspartat zur Nährlösung können wir die Antwort der Photorezeptoren proportional stärker darstellen oder vollständig isolieren.
Damit lässt sich das Wirkverhalten wie auch der Wirkort verschiedener Substanzen auf die einzelnen Neuronenschichten untersuchen. Wird z.B. eine Verminderung der b-Welle unter Exposition eines Wirkstoffs beobachtet, so kann das an einer Schädigung der Photorezeptoren liegen, die sich dann indirekt auf die Amplitude der b-Welle auswirkt - oder an den Zelltypen, die die b-Welle erzeugen. Mithilfe der separaten Untersuchung von a- und b-Welle können wir das differenzieren. Mit dem ERG hat man ideale Ausgangsbedingungen, um hoch standardisierte Biokompatibiltiätsstudien an einem Organkulturmodel durchzuführen.
Wie ist der Projektstand?
Nach der Etablierung des experimentellen Aufbaus in den letzten Jahren erfolgt nun die kontinuierliche Verfeinerung und Optimierung der Untersuchungsmethode. Die zuverlässige Detektion sowie die präzise Messbarkeit eines möglichen retinatoxischen Effektes konnten wir bereits anhand mehrerer zu untersuchender Substanzen zeigen.
Das Projektteam
Prof. Dr. med. Kai Januschowski (Arbeitsgruppenleiter)
Loic Sermeus
Publikationen
- Januschowski K, Mueller S, Dollinger R, Schnichels S, Hofmann J, Spitzer MS, Bartz-Schmidt KU, Szurman P, Thaler S. Investigating retinal toxicity of tempol in a model of isolated and perfused bovine retina. Graefes Arch Clin Exp Ophthalmol. 2014 Jun;252(6):935-41. doi: 10.1007/s00417-014-2632-4. Epub 2014 May 2. PMID: 24789463
- Januschowski K, Schnichels S, Hagemann U, Koch V, Hofmann J, Spitzer MS, Bartz-Schmidt KU, Szurman P, Lüke M, Aisenbrey S. Electrophysiological toxicity testing of VEGF Trap-Eye in an isolated perfused vertebrate retina organ culture model.Acta Ophthalmol. 2014 Jun;92(4):e305-11. doi: 10.1111/aos.12300. Epub 2013 Nov 8. PMID: 24206925
- Januschowski K, Maddani R, Mueller S, Lueke M, Spitzer MS, Schultheiss M, Bartz-Schmidt KU, Szurman P. Comparing the effects of two different irrigation solutions on an isolated perfused vertebrate retina. Ophthalmic Res. 2012
- Januschowski K, Krupp C, Mueller S, Hofmann K, Schnichels S, Hagemann U, Spitzer MS, Bartz-Schmidt KU, Aisenbrey S. Investigating short-term toxicity of melphalan in a model of an isolated and superfused bovine retina. Graefes Arch Clin Exp Ophthalmol. 2015 Sep 3. [Epub ahead of print] PMID: 26335534
- Januschowski K, Müller S, Krupp C, Spitzer MS, Hurst J, Schultheiss M, Bartz-Schmidt KU, Szurman P, Schnichels S. Glutamate and hypoxia as a stress model for the isolated perfused vertebrate retina. J Vis Exp. 2015 Mar 22;(97). doi: 10.3791/52270. PMID: 25868118
- Januschowski K, Schnichels S, Hagemann U, Koch V, Hofmann J, Spitzer MS, Bartz-Schmidt KU, Szurman P, Lüke M, Aisenbrey S.Electrophysiological toxicity testing of VEGF Trap-Eye in an isolated perfused vertebrate retina organ culture model. Acta Ophthalmol. 2014 Jun;92(4):e305-11. doi: 10.1111/aos.12300. Epub 2013 Nov 8. PMID: 24206925






