Projekt-Zusammenfassung
Ziel dieser Arbeitsgruppe ist die Entwicklung und Optimierung eines neuartigen Glaskörperersatz auf Hydrogel-Basis, welcher genügend Festigkeit, Stabilität, Viskosität und Quelldruck aufweist, um eine ausreichende Tamponade im Glaskörperraum zu gewähren. Neben guten Tamponade-, rheologischen und optischen Eigenschaften soll das Glaskörperäquivalent gleichzeitig als Trägermatrix zur verzögerten Medikamentenfreisetzung dienen. Derzeit werden die ersten Funktionsmuster in präklinischen Studien getestet.
Wussten Sie schon?
Der Glaskörper hat ein Volumen von ca. 4 ml und wiegt ungefähr 4 g bei einer Dichte von 1,0053 g/cm3. Der Refraktionsindex beträgt 1,336. Bei einer Wellenlänge zwischen 300 und 1400 nm besteht eine Lichtdurchlässigkeit von etwa 90%. Der pH-Wert im Glaskörperraum liegt zwischen 7,3-7,5. Der menschliche Glaskörper besteht zu 98 % aus Wasser und zu 2 % aus den Makromolekülen Kollagen und Hyaluronsäure.
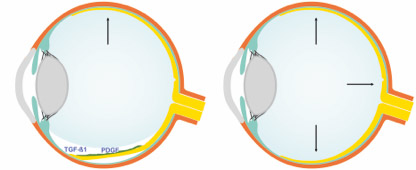
Die Tamponadewirkung von hydrophoben Endotamponaden (links) im Vergleich zum neu entwickelten Hydrogel-Glaskörperersatz (rechts). Während links keine vollständige Tamponade erreicht werden kann und sich Wachstumsfaktoren unterhalb der Tamponade konzentrieren und so proliferative Prozesse befördern, kann ein natürlicher Glaskörperersatz eine volle Tamponade erreichen und sich dennoch in die natürliche Homöostase einfügen.
Klinischer Hintergrund
Die Behandlung komplizierter Netzhaut- und Glaskörpererkrankungen ist eine der zentralen Herausforderungen in der operativen Augenheilkunde. Im Rahmen der Standardtherapie wird der natürliche Glaskörper entfernt (Vitrektomie) und die Netzhaut mit einer temporären Tamponade stabilisiert. Trotz wesentlicher technologischer Innovationen löst die pars-plana-Vitrektomie in Kombination mit Endotamponaden nicht alle Probleme der Ablatiochirurgie. Auch modernste Tamponadematerialien bieten keine zufriedenstellende Antwort auf Mehrlochsituationen an unterschiedlichen Stellen, die Problematik der proliferativen Vitreoretinopathie (PVR) oder die persistierende Hypotonie.
Warum sind bestehende Standardtherapien nicht ausreichend?
Bisherige Tamponaden sind in ihren Materialeigenschaften hydrophob (Gase, Öle, semifluorierte Alkane) und üben ihre tamponierenden Eigenschaften über Auftriebsvektor und Oberflächenspannung aus. Obwohl das in der klinischen Anwendung durchaus erfolgreich ist, birgt der hydrophobe Charakter auch deutliche Nachteile, die beispielsweise die PVR-Entwicklung eher fördern als hemmen. Hydrophobe Tamponaden sind aus folgenden Gründen in ihrer Wirkung limitiert, weil
(1) keine vollständige Tamponade erreicht werden kann,
(2) keine gleichmäßige Tamponade aller Netzhautanteile erreicht wird,
(3) PVR nicht verhindert wird.
Die Tamponade-Wirkung weicht auch völlig von den Eigenschaften des natürlichen Glaskörpers, der als Komposit-Hydrogel hydrophil ist und so eine gleichmäßige Andruckwirkung erzielt.
Zielsetzung
Wünschenswert im Sinne einer idealen Tamponade wäre ein Glaskörperersatz, der dem natürlichen Glaskörper nachempfunden ist, also seine tamponierende Wirkung eher durch Quelldruck und Viskosität ausübt. Moderne Hydrogele zeigen eine gute, Quelldruck-vermittelte Tamponadewirkung bei gleichzeitig sehr guten optischen Eigenschaften. Verschiedene Ansätze erstrecken sich vorwiegend auf den Einsatz quervernetzter semisynthetischer oder vollsynthetischer Polymere. Diese Hydrogele besitzen nicht nur ausgezeichnete refraktive und rheologische Eigenschaften sowie eine hervorragende Biokompatibilität, sondern wirken zusätzlich antiadhäsiv und antimigrativ. Dadurch ließen sich PVR Reaktionen alleine durch die Hydrogel-Tamponade reduzieren. Die zusätzliche Möglichkeit einer kontrollierten Medikamentenfreisetzung durch entsprechend beladene Hydrogele kann weitere antiproliferative, neuroprotektive oder nutritive Funktionen erfüllen.
Wie ist der Projektstand?
Im Jahr 2002 wurde ein Tissue Engineering-Labor zur Entwicklung eines künstlichen Glaskörperäquivalentes eingerichtet. Das Projekt wird seit Beginn über Stiftungszuwendungen, ein Fellowship-Projekt der Europäischen Union und der Deutschen Forschungsgemeinschaft gefördert. Über die Projektförderungen konnten wir in der Forschungsgruppe mehrere Doktoranden, Post-Doktoranden und ausländische Stipendiaten integrieren. Inzwischen wurden mehrere Glaskörper-Äquivalente auf Hydrogel-Basis (quervernetzte Glycosaminoglykane) entwickelt und als Medikamententräger zur verzögerten Freisetzung antiproliferativ wirksamer Medikamente optimiert. Wir konnten zeigen, dass unser Glaskörperersatz auf Hydrogel-Basis eine hervorragende Langzeit-Stabilität und -Verträglichkeit hat. Die neuesten Entwicklungen scheinen sogar die Kataraktprogression nach einer Vitrektomie zu verzögern. Zukünftige Entwicklungen von Hydrogel-Tamponaden werden auch die Bedeutung des Glaskörperkortex einbeziehen. Derzeit laufen die ersten präklinischen Studien unter Aufsicht der Ethikkommission Saarbrücken.

Prototypen des neuen Glaskörperersatz auf Hydrogel-Basis. Es kann über 23gauge injiziert werden und erhält sich dennoch eine ausreichende Steifigkeit für hochwertige Tamponade-Eigenschaften
Wie sind wir methodisch aufgestellt?
Zellkulturtechniken mit Proliferations- und Toxizitäts-Assays, Immunfluoreszenz-Aufarbeitung histologischer Gewebeschnitte, Antikörper-Assays, Partikelgrößenmessung, Photometrische Konzentrationsmessung in Gewebe, HPLC, Western-Blot, FACS-Analyse, Gewebepräparation mit Materialgewinnung und Zellzählung und Spezialfärbungen, in-vivo Versuche operativ mit Langzeitbeobachtung (Vitreoretinale Operationseinheit entsprechend Augen-OP, Foto, Spaltlampe, Augendruckmessung), Elektrophysiologische Untersuchungseinheit
Das Projektteam
Prof. Dr. med. Peter Szurman (Arbeitsgruppenleiter)
Prof. Dr. med. Kai Januschowski









