Projekt-Zusammenfassung
Ziel dieser Arbeitsgruppe ist die elektrophysiologische Untersuchung isolierter Retinakulturen während und nach der Umspülung mit einer Testsubstanz zur Detektion etwaig retinatoxischer Effekte. Hierzu konnten wir ein Organmodell der isolierten superfundierten Netzhautpräparaten aufbauen. Das erlaubt ein in-vivo Monitoring der Netzhautfunktion unter definierter Exposition von zu testenden Wirkstoffen über einen Zeitraum von 36 Stunden. Somit wird ein direktes Monitoring substanzspezifischer Einflüsse auf die Netzhautfunktion ermöglicht. Zusätzlich besteht eine zellbiologische Laborstruktur, die eine standardisierte Bestimmung der selektiven Medikamententoxizität an kultivierten retinalen Zelllinien erlaubt. Seit Bestehen der Arbeitsgruppe haben wir grundlegende Erkenntnisse zum medikamentösen Targeting retinaler Erkrankungen erzielt und damit die klinische Sicherheit neu eingeführter Medikamente verbessert.
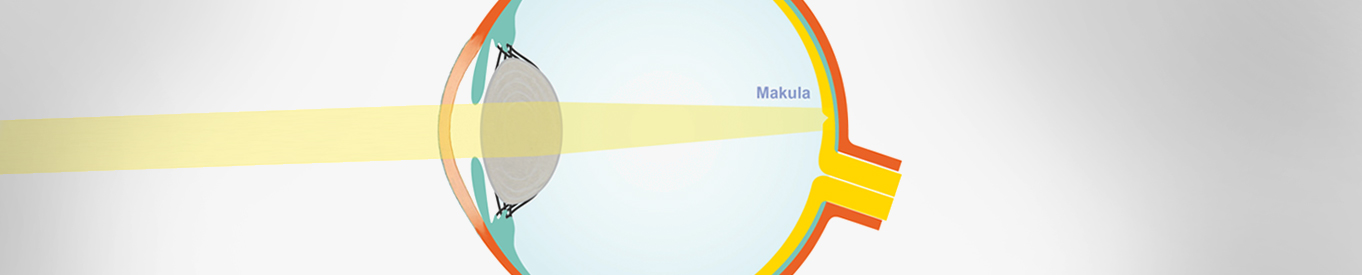
Netzhaut - Anatomie & Physiologie
Die Netzhaut befindet sich im hinteren Teil des Auges, in dem die Lichtrezeptoren liegen und die ersten Informationen über das Sehen verarbeitet werden. Sie ist, wie das Gehirn, durch die sogenannte Blut-Retina-Schranke vom restlichen Organismus getrennt.
Als erste Schicht, die das Licht verarbeitet, sind die Photorezeptoren (Stäbchen und Zapfen) zu nennen. Danach schließt sich die äußere plexiforme Schicht an, in der die Fortsätze der Photorezeptoren synaptisch mit den Horizontal- und Bipolarzellen verschaltet sind, die mit den Zellkörpern der Amakrinenzellen die innere Körnerschicht bilden. Weiter nach Innen schließt sich die innere plexiforme Schicht an, in der die Synapsenkontakte der amakrinen Zellen und die der Bipolarzellen mit den Ganglienzellen zu treffen sind. Aus den Axonen der Ganglienzellen wird die Ganglienzellfaserschicht gebildet, die als Nervus opticus zur Sehrinde ziehen. Die Müllerstützzellen bilden die Lamina limitans externa und die Lamina limitans interna.
Die Reiztransduktion in der Netzhaut ist für die Wahrnehmung visueller Reize essentiell und kann zugleich durch Ableitung eines ERGs gemessen werden. Das besondere an den Sinnesrezeptoren der Retina ist, dass Sie im Ruhezustand depolarisiert und im Erregungszustand hyperpolarisiert sind.
Bei anderen neuronalen Mechanismen der Reizverarbeitung im Körper ist das Gegenteil der Fall. Diese Hyperpolarisation ist im ERG messbar.
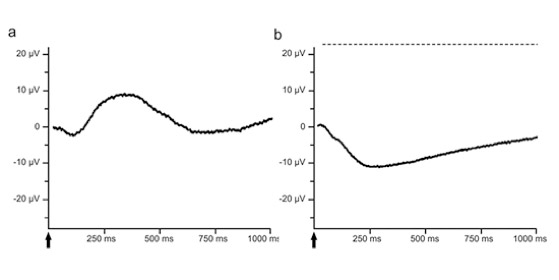
a: Antwort des Photorezeptors im zeitlichen Verlauf dargestellt. Der Lichtreiz ist durch den Pfeil markiert
b: Antwort des höheren neuronalen Netzwerkes im zeitlichen Verlauf dargestellt. Der Lichtreiz ist durch den Pfeil markiert.
Klinischer Hintergrund
Während der Behandlung von Netzhaut- und Glaskörpererkrankungen kommt die Netzhaut nach der Entfernung des natürlichen Glaskörpers (Vitrektomie) mit unterschiedlichen Substanzen in Kontakt. Je nach Krankheitsbild kann auch eine (temporäre) Endotamponade über längere Zeit nach der Operation in der Glaskörperkavität verbleibend. Hierfür müssen diese Substanzen gewisse Voraussetzungen erfüllen. Mithilfe der superfundierten Netzhaut ist es möglich eine potentielle Retinatoxizität vorab zu testen.
Warum sind bestehende Standardtherapien nicht ausreichend?
Aktuell ist es in vitro und in vivo nur leidlich möglich, eine standardisierte Beziehung zwischen Dosis, Applikationszeit und retinaler Toxizität herzustellen. Ein echter in vitro Ansatz ist derzeit aufgrund des komplexen Aufbaus der Retina und deren Störanfälligkeit sowie der fehlenden Perfusion nicht praktikabel.
Zielsetzung
Um den Einsatz von Tierversuchen zu minimieren, verfolgen wir mit der superfundierten Netzhaut einen ex-vivo Ansatz. Hierbei wird eine bovine Netzhaut mit einer Nährlösung und der zu testenden Substanz umspült und im Anschluss eine elektrophysiologische Untersuchungen durchgeführt. Je nach dem Muster der retinalen Antwort auf einen Lichtreiz kann somit auf eine mögliche Retinatoxizität der Substanz geschlossen werden.
So funktioniert das ERG (Elektroretinographie)
Das ERG wurde erstmalig 1849 von Du-Bois-Raymond am Bulbus eines enukleierten Fischauges abgeleitet. Bereits 1945 wurde das ERG klinisch nutzbar gemacht.
Heute ist es der Goldstandard zur Diagnostik bei Netzhautdegenerationserkrankungen oder -dystrophien. Bei einem ERG kann man zwei Wellenkomponenten unterscheiden, eine a-Welle (Hyperpolarisation) und eine b-Welle (Depolarisation). Die a-Welle liefert Informationen über die Funktionalität der Lichtrezeptoren der Netzhaut (Abb. a). Sie ist das durch die Photorezeptoren gebildete Summenpotential, die als erste Antwort auf einen Lichtreiz in Form eines negativen Ausschlags im ERG erscheint. Auf diesen ersten negativen Ausschlag folgt mit einer kurzen Latenz ein positiver Ausschlag, die b-Welle. Von der b-Welle im ERG zieht man Rückschlüsse auf die Funktion der höheren neuronalen Netzwerke innerhalb der Netzhaut (Abb. b). Das Zusammenspiel mehrerer Zelltypen generiert die b-Welle. Sie ist damit als Indikator für die komplexen, integrierenden Netzwerkfunktionen sehr sensibel.
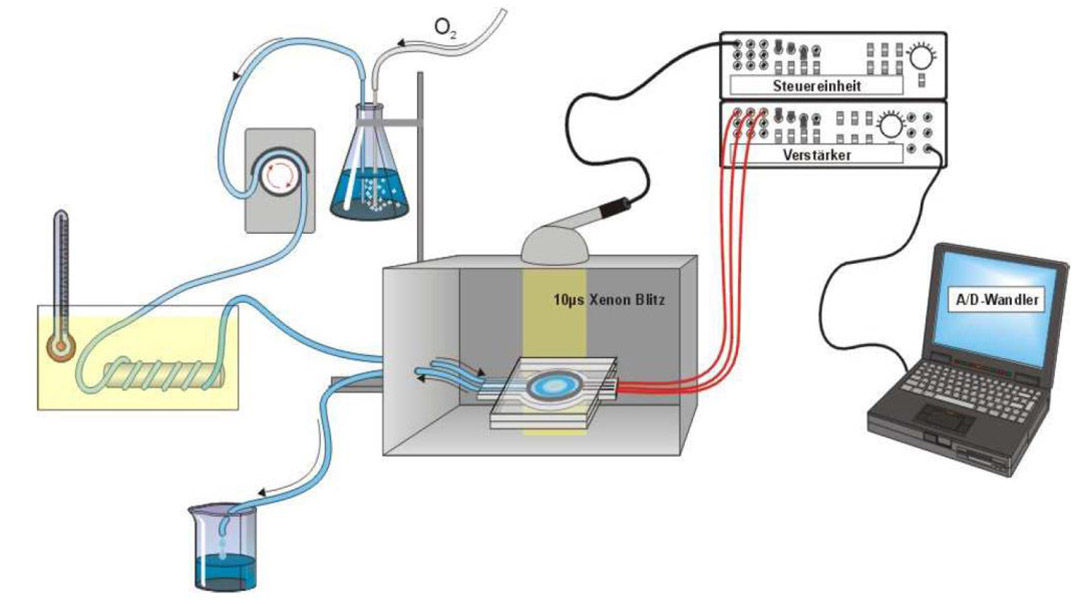
Messung der Retinalen Biokompatibilität
Durch unterschiedliche Reizintensitäten oder durch Zugabe von Aspartat zur Nährlösung können wir die Antwort der Photorezeptoren proportional stärker darstellen oder vollständig isolieren.
Damit lässt sich das Wirkverhalten wie auch der Wirkort verschiedener Substanzen auf die einzelnen Neuronenschichten untersuchen. Wird z.B. eine Verminderung der b-Welle unter Exposition eines Wirkstoffs beobachtet, so kann das an einer Schädigung der Photorezeptoren liegen, die sich dann indirekt auf die Amplitude der b-Welle auswirkt - oder an den Zelltypen, die die b-Welle erzeugen. Mithilfe der separaten Untersuchung von a- und b-Welle können wir das differenzieren. Mit dem ERG hat man ideale Ausgangsbedingungen, um hoch standardisierte Biokompatibiltiätsstudien an einem Organkulturmodel durchzuführen.
Wie ist der Projektstand?
Nach der Etablierung des experimentellen Aufbaus in den letzten Jahren erfolgt nun die kontinuierliche Verfeinerung und Optimierung der Untersuchungsmethode. Die zuverlässige Detektion sowie die präzise Messbarkeit eines möglichen retinatoxischen Effektes konnten wir bereits anhand mehrerer zu untersuchender Substanzen zeigen.
Das Projektteam
Prof. Dr. med. Kai Januschowski (Arbeitsgruppenleiter)
Loic Sermeus
Publikationen
- Januschowski K, Mueller S, Dollinger R, Schnichels S, Hofmann J, Spitzer MS, Bartz-Schmidt KU, Szurman P, Thaler S. Investigating retinal toxicity of tempol in a model of isolated and perfused bovine retina. Graefes Arch Clin Exp Ophthalmol. 2014 Jun;252(6):935-41. doi: 10.1007/s00417-014-2632-4. Epub 2014 May 2. PMID: 24789463
- Januschowski K, Schnichels S, Hagemann U, Koch V, Hofmann J, Spitzer MS, Bartz-Schmidt KU, Szurman P, Lüke M, Aisenbrey S. Electrophysiological toxicity testing of VEGF Trap-Eye in an isolated perfused vertebrate retina organ culture model.Acta Ophthalmol. 2014 Jun;92(4):e305-11. doi: 10.1111/aos.12300. Epub 2013 Nov 8. PMID: 24206925
- Januschowski K, Maddani R, Mueller S, Lueke M, Spitzer MS, Schultheiss M, Bartz-Schmidt KU, Szurman P. Comparing the effects of two different irrigation solutions on an isolated perfused vertebrate retina. Ophthalmic Res. 2012
- Januschowski K, Krupp C, Mueller S, Hofmann K, Schnichels S, Hagemann U, Spitzer MS, Bartz-Schmidt KU, Aisenbrey S. Investigating short-term toxicity of melphalan in a model of an isolated and superfused bovine retina. Graefes Arch Clin Exp Ophthalmol. 2015 Sep 3. [Epub ahead of print] PMID: 26335534
- Januschowski K, Müller S, Krupp C, Spitzer MS, Hurst J, Schultheiss M, Bartz-Schmidt KU, Szurman P, Schnichels S. Glutamate and hypoxia as a stress model for the isolated perfused vertebrate retina. J Vis Exp. 2015 Mar 22;(97). doi: 10.3791/52270. PMID: 25868118
- Januschowski K, Schnichels S, Hagemann U, Koch V, Hofmann J, Spitzer MS, Bartz-Schmidt KU, Szurman P, Lüke M, Aisenbrey S.Electrophysiological toxicity testing of VEGF Trap-Eye in an isolated perfused vertebrate retina organ culture model. Acta Ophthalmol. 2014 Jun;92(4):e305-11. doi: 10.1111/aos.12300. Epub 2013 Nov 8. PMID: 24206925