iPS Stammzell-Transplantation an der Netzhaut
- Details
- Zugriffe: 40297
Projekt-Zusammenfassung
Ziel dieses Europäischen Forschungsverbunds ist die Etablierung einer neuen Methode zur Transplantation konfluenter induzierter pluripotenter Stammzellen (iPS) auf einer Trägermatrix sowie der dazugehörige Aufbau und Logistik einer Biobank von speziell charakterisierten und mit einer neuen Methode kryokonservierten Stammzelllinien.
Wussten Sie schon?
Optische Reize werden von der Netzhaut aufgenommen und durch den Nervus Optikus zu den primären und sekundären optischen Zentren des Zentralnervensystems weitergeleitet. Die Netzhaut reicht vom Sehnervenkopf bis zur Ora serrata. Nur an diesen beiden Stellen ist sie fest mit der Unterlage verbunden. Bei der mikroskopischen Untersuchung erkennt man in der sensorischen Netzhaut acht Schichten sowie das Pigmentepithel und die Bruchsche Membran. Die Macula lutea (gelber Fleck) ist ein speziell differenziertes kreisförmiges Netzhautareal. Es reicht temporal von der Papille im horizontalen Meridian bis ca. 5,5 mm nach temporal. Eine Besonderheit stellt auch die Vaskularisation der zentralen Retina dar. Eine doppelte Gefäßversorgung sichert den außerordentlich lebhaften retinalen Stoffwechsel. Sowohl der retinale als auch der chorioidale Kreislauf können Ursprung pathologischer Prozesse sein. Die Avaskularitat der Foveola wird augenscheinlich kompensiert durch Reichtum von Ziliararterien, die in die Aderhaut hinter der Makula eintreten. Das retinale Pigmentepithel zeichnet sich durch eine eindrucksvolle Reaktionsfähigkeit aus. Sie reicht von der permanenten Phagozytose der nachwachsenden Rezeptorspitzen bis zur fibrösen "Pseudometaplasie".
 Klinischer Hintergrund
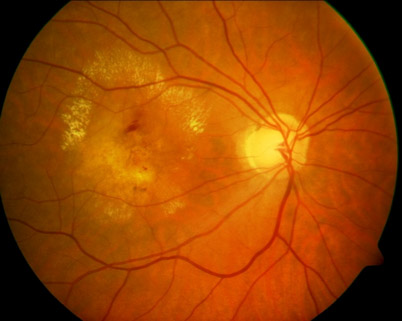
Klinischer Hintergrund
Ein funktionierendes Retinales Pigmentepithel (RPE) ist Grundvoraussetzung zur Erhaltung der äußeren neuralen Retina und Choriokapillaris. Pathophysiologische, aber auch altersbedingte Veränderungen des RPE können vielerlei Konsequenzen für umliegende Strukturen nach sich ziehen, beispielsweise für die Bruch’sche Membran (BM), die Choriokapillaris, die Photorezeptoren oder die extrazelluläre Matrix. Diese tragen infolge zur Pathogenese multipler Visusbeeinträchtigungen bei, u.a. auch zur Altersbedingten Makuladegeneration (AMD). Sie ist die häufigste Erblindungsursache in den Industriestaaten. Ca. 8,7 % der Weltbevölkerung leiden daran. Die zurzeit verfügbaren Medikamente können AMD nur verlangsamen, nicht heilen. Eine lebenslange Therapie mit hohen Kosten und großem Aufwand ist für die Patienten nötig.
Warum sind bestehende Standardtherapien nicht ausreichend?
Die einzige Therapie, die bisher nachweislich eine AMD dauerhaft heilen kann, ist die subretinale Membranextraktion mit autologem Ersatz der retinalen Pigmentepithelzell- (RPE) Schicht. Die bisherigen Methoden (Makulatranslokation, RPE-Bruch-Aderhautpatch) zeigen jedoch eine unvertretbar hohe Komplikationsrate und haben sich deshalb nicht durchgesetzt.
Deutlich weniger Invasivität verspricht die Technik der subretinalen RPE-Transplantation. Versuche haben gezeigt, dass eine subretinale Transplantation von retinalen Pigmentepithelzellen (RPE-Zellen) die Funktionen der Retina deutlich verbessert. Erste Langzeitstudien an AMD-Patienten, bei denen autologe RPE-Zellen aus peripheren Arealen isoliert, ex-vivo aufkonzentriert und wieder subretinal unter die Makula injiziert wurden, zeigen ebenfalls die Unbedenklichkeit und eine Verbesserung des Visus. Allerdings ist dieser Ansatz limitiert durch:
- Geringe Polarität der sedimentierten Zellen
- Keine Ausbildung eines konfluenten Zellrasens
- Eine autologe Transplantation in AMD-Patienten behält die genetische Disposition für AMD bei. In der Praxis zeigen Patienten mit Aderhautpatch eine erneute Ausbildung areolärer Atrophie-Areale.
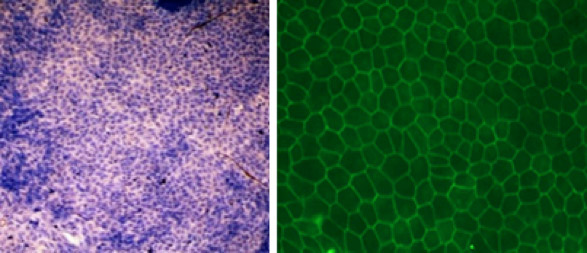
Konfluent kultivierte Stammzellen zur Behandlung der Makuladegeneration
Zielsetzung
Ziel dieses Projektes ist die Etablierung einer neuen Methode zur Transplantation konfluenter induzierter pluripotenter Stammzellen (iPS) auf einer Trägermatrix. Dazu werden iPS-Zelllinien zunächst charakterisiert und zur Konfluenz gebracht. Anschließend werden sie zu RPE-Zellen redifferenziert und auf einer Trägermatrix bis zur Konfluenz kultiviert. Der charakterisierte iPS-RPE-Patch wird unter die Netzhaut transplantiert. Ziel des Europäischen Forschungsverbunds ist die Etablierung von speziell charakterisierten Zelllinien und mit einer neuen Methodik kryokonservierten Stammzelllinien in einer Kryobank. Der Versand eines individualisierten iPS-RPE-Patches an die transplantierende Klinik erfolgt in einer lückenlosen Kühlkette, so dass das Transplantat direkt vor der Operation aufgetaut und sich nativ ohne Funktionsverlust transplantieren lässt. Dazu wird eine neue endoskopische Operationstechnik zur minimal-invasiven Transplantation dieser iPS-RPE-Patches entwickelt.
Wie ist der Projektstand?
Das Vorhaben gewinnt durch die Expertise von international anerkannten Kooperationspartnern an Bedeutsamkeit und befindet sich aktuell im Verfahren um ein positives BMBF-Votum.
Das Projektteam
PD Dr. Dr. med. Boris Stanzel (Arbeitsgruppenleiter)
Dr. med. Annekatrin Rickmann
Dr. rer. nat. Silke Wahl
Prof. Dr. med. Peter Szurman
Weitwinkel-Retina-Implantat
- Details
- Zugriffe: 14820
Projekt-Zusammenfassung
Ziel ist die Entwicklung von minimal-invasiven Retina-Implantaten (Netzhautchip) zur Wiedererlangung eines orientierenden Sehens bei vollständig erblindeten Patienten. Unsere Retinaprothese verfolgt einen ganz neuen technologischen Ansatz.
Wussten Sie schon?
Erstmals soll eine Weitwinkelprojektion zur Erstellung eines natürlichen Gesichtsfelds realisiert werden. Durch die zusätzliche drahtlose opto-elektrische Signalübertragung sollen keine Drähte mehr an oder in das Auge hineinführen.
 Klinischer Hintergrund
Klinischer Hintergrund
Weltweit leiden etwa 3 Millionen Menschen an erblichen Netzhaut-Erkrankung. Bei der Retinitis pigmentosa, der häufigsten Form dieser erblichen Netzhauterkrankungen, kommt es zu einem langsamen Absterben der Photorezeptoren, was im Endstadium zur vollständigen Erblindung führen kann.
Abbildung: Patientin mit Argus II-Netzhautchip bei Rehabilitationstraining.
Warum sind bestehende Standardtherapien nicht ausreichend?
Bisherige Retina-Implantate zeigen Limitationen in Bezug auf ein sehr geringes Gesichtsfeld (<15°), einer reduzierten Auflösung (≤ 1500 Pixel), externer Energiezufuhr (transsklerale Kabellösung), oft großen extraokulare Bauteile und langer Operationszeit. Die im besten Fall erreichbare Funktion ist derzeit leider auf ein orientierendes Konturensehen innerhalb eines kleinen Gesichtsfeld-Radius beschränkt. Eine breite Anwendung wird sich aber erst ergeben, wenn für alle eine substanzielle Optimierung und Verbesserung erreicht wird.
Zielsetzung
Ziel ist die Entwicklung eines Retina-Implantats mit ganz neuem Ansatz. Dabei sollen Features wie Kabellosigkeit (keine extraokularen Bauteile außer einer Brille), eine drahtlose Energie- und Datenübertragung auf das Implantat, ein Weitwinkeleffekt zur Erstellung eines natürlichen Gesichtsfelds und eine flexible Selbstfixierung des intraokularen Implantats realisiert werden.
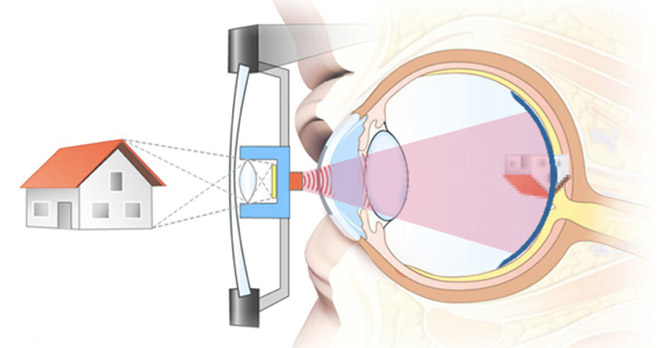
Weitwinkel-Retina-Implantat zur erstmaligen Bereitstellung eines ausreichenden Gesichtsfeld-Bereichs
Wie ist der Projektstand?
Aufbauend auf die klinische Erfahrung mit der Implantation, der klinischen Überwachung und auch der Explantation von epiretinalen und subretinalen Chips fließen diese Kompetenzen inklusive der Erfahrung in der Grundlagenforschung samt der daraus resultierender Patente bereits in die präklinischen Entwicklung dieses Chips mit ein. Durch die Kooperation mit dem Fraunhofer-Institut für Biomedizinische Technik IBMT sowie weiteren Industriepartnern streben wir nach Abschluss der Entwicklung, Validierung der Funktion und Biokompatibilität im weiteren Verlauf die klinische Überprüfung an.
Das Projektteam
Prof. Dr. med. Peter Szurman (Arbeitsgruppenleiter)
Prof. Dr. med. Kai Januschowski
Kooperationspartner
Fraunhofer-Institut für Biomedizinische Technik IBMT
Glaskörperersatz (Artificial Vitreous)
- Details
- Zugriffe: 12234
Projekt-Zusammenfassung
Ziel dieser Arbeitsgruppe ist die Entwicklung und Optimierung eines neuartigen Glaskörperersatz auf Hydrogel-Basis, welcher genügend Festigkeit, Stabilität, Viskosität und Quelldruck aufweist, um eine ausreichende Tamponade im Glaskörperraum zu gewähren. Neben guten Tamponade-, rheologischen und optischen Eigenschaften soll das Glaskörperäquivalent gleichzeitig als Trägermatrix zur verzögerten Medikamentenfreisetzung dienen. Derzeit werden die ersten Funktionsmuster in präklinischen Studien getestet.
Wussten Sie schon?
Der Glaskörper hat ein Volumen von ca. 4 ml und wiegt ungefähr 4 g bei einer Dichte von 1,0053 g/cm3. Der Refraktionsindex beträgt 1,336. Bei einer Wellenlänge zwischen 300 und 1400 nm besteht eine Lichtdurchlässigkeit von etwa 90%. Der pH-Wert im Glaskörperraum liegt zwischen 7,3-7,5. Der menschliche Glaskörper besteht zu 98 % aus Wasser und zu 2 % aus den Makromolekülen Kollagen und Hyaluronsäure.
Die Tamponadewirkung von hydrophoben Endotamponaden (links) im Vergleich zum neu entwickelten Hydrogel-Glaskörperersatz (rechts). Während links keine vollständige Tamponade erreicht werden kann und sich Wachstumsfaktoren unterhalb der Tamponade konzentrieren und so proliferative Prozesse befördern, kann ein natürlicher Glaskörperersatz eine volle Tamponade erreichen und sich dennoch in die natürliche Homöostase einfügen.
Klinischer Hintergrund
Die Behandlung komplizierter Netzhaut- und Glaskörpererkrankungen ist eine der zentralen Herausforderungen in der operativen Augenheilkunde. Im Rahmen der Standardtherapie wird der natürliche Glaskörper entfernt (Vitrektomie) und die Netzhaut mit einer temporären Tamponade stabilisiert. Trotz wesentlicher technologischer Innovationen löst die pars-plana-Vitrektomie in Kombination mit Endotamponaden nicht alle Probleme der Ablatiochirurgie. Auch modernste Tamponadematerialien bieten keine zufriedenstellende Antwort auf Mehrlochsituationen an unterschiedlichen Stellen, die Problematik der proliferativen Vitreoretinopathie (PVR) oder die persistierende Hypotonie.
Warum sind bestehende Standardtherapien nicht ausreichend?
Bisherige Tamponaden sind in ihren Materialeigenschaften hydrophob (Gase, Öle, semifluorierte Alkane) und üben ihre tamponierenden Eigenschaften über Auftriebsvektor und Oberflächenspannung aus. Obwohl das in der klinischen Anwendung durchaus erfolgreich ist, birgt der hydrophobe Charakter auch deutliche Nachteile, die beispielsweise die PVR-Entwicklung eher fördern als hemmen. Hydrophobe Tamponaden sind aus folgenden Gründen in ihrer Wirkung limitiert, weil
(1) keine vollständige Tamponade erreicht werden kann,
(2) keine gleichmäßige Tamponade aller Netzhautanteile erreicht wird,
(3) PVR nicht verhindert wird.
Die Tamponade-Wirkung weicht auch völlig von den Eigenschaften des natürlichen Glaskörpers, der als Komposit-Hydrogel hydrophil ist und so eine gleichmäßige Andruckwirkung erzielt.
Zielsetzung
Wünschenswert im Sinne einer idealen Tamponade wäre ein Glaskörperersatz, der dem natürlichen Glaskörper nachempfunden ist, also seine tamponierende Wirkung eher durch Quelldruck und Viskosität ausübt. Moderne Hydrogele zeigen eine gute, Quelldruck-vermittelte Tamponadewirkung bei gleichzeitig sehr guten optischen Eigenschaften. Verschiedene Ansätze erstrecken sich vorwiegend auf den Einsatz quervernetzter semisynthetischer oder vollsynthetischer Polymere. Diese Hydrogele besitzen nicht nur ausgezeichnete refraktive und rheologische Eigenschaften sowie eine hervorragende Biokompatibilität, sondern wirken zusätzlich antiadhäsiv und antimigrativ. Dadurch ließen sich PVR Reaktionen alleine durch die Hydrogel-Tamponade reduzieren. Die zusätzliche Möglichkeit einer kontrollierten Medikamentenfreisetzung durch entsprechend beladene Hydrogele kann weitere antiproliferative, neuroprotektive oder nutritive Funktionen erfüllen.
Wie ist der Projektstand?
Im Jahr 2002 wurde ein Tissue Engineering-Labor zur Entwicklung eines künstlichen Glaskörperäquivalentes eingerichtet. Das Projekt wird seit Beginn über Stiftungszuwendungen, ein Fellowship-Projekt der Europäischen Union und der Deutschen Forschungsgemeinschaft gefördert. Über die Projektförderungen konnten wir in der Forschungsgruppe mehrere Doktoranden, Post-Doktoranden und ausländische Stipendiaten integrieren. Inzwischen wurden mehrere Glaskörper-Äquivalente auf Hydrogel-Basis (quervernetzte Glycosaminoglykane) entwickelt und als Medikamententräger zur verzögerten Freisetzung antiproliferativ wirksamer Medikamente optimiert. Wir konnten zeigen, dass unser Glaskörperersatz auf Hydrogel-Basis eine hervorragende Langzeit-Stabilität und -Verträglichkeit hat. Die neuesten Entwicklungen scheinen sogar die Kataraktprogression nach einer Vitrektomie zu verzögern. Zukünftige Entwicklungen von Hydrogel-Tamponaden werden auch die Bedeutung des Glaskörperkortex einbeziehen. Derzeit laufen die ersten präklinischen Studien unter Aufsicht der Ethikkommission Saarbrücken.

Prototypen des neuen Glaskörperersatz auf Hydrogel-Basis. Es kann über 23gauge injiziert werden und erhält sich dennoch eine ausreichende Steifigkeit für hochwertige Tamponade-Eigenschaften
Wie sind wir methodisch aufgestellt?
Zellkulturtechniken mit Proliferations- und Toxizitäts-Assays, Immunfluoreszenz-Aufarbeitung histologischer Gewebeschnitte, Antikörper-Assays, Partikelgrößenmessung, Photometrische Konzentrationsmessung in Gewebe, HPLC, Western-Blot, FACS-Analyse, Gewebepräparation mit Materialgewinnung und Zellzählung und Spezialfärbungen, in-vivo Versuche operativ mit Langzeitbeobachtung (Vitreoretinale Operationseinheit entsprechend Augen-OP, Foto, Spaltlampe, Augendruckmessung), Elektrophysiologische Untersuchungseinheit
Das Projektteam
Prof. Dr. med. Peter Szurman (Arbeitsgruppenleiter)
Prof. Dr. med. Kai Januschowski