Vorderkammer-Glaukommodell
Projekt-Zusammenfassung
Ziel dieser Arbeitsgruppe ist die Evaluierung unterschiedlicher Einflussgrößen auf die Strukturen des Kammerwinkels, vor allem auf das Trabekelmaschenwerk, das eine wichtige Rolle in der Glaukom-Pathogenese spielt. Mit einem eigenentwickelten Vorderkammer-Glaukommodell (MoVoKaGaAu) kann die Wirkung von neuen Glaukommedikamenten und experimentellen Glaukomoperationen auf die Abflussleichtigkeit (Fazilität) des Trabekelmaschenwerks untersucht werden. Der Kurzzeitverlauf des Augeninnendruckes wird im Rahmen einer kontinuierlichen Druckaufzeichnung unter möglichst physiologischen Bedingungen mittels einer modifizierten Vorderkammer, mit künstlicher Kammerwasserzirkulation, erfasst.
Wussten Sie schon?
Das Trabekelmaschenwerk ist zeitlebens unterschiedlichsten Stressoren ausgesetzt. Dabei scheinen unterschiedlichste Faktoren wie phagozytäre, oxidative, mechanische und metabolische Prozesse Einfluss zu nehmen. Das juxtakanalikuläre Trabekelmaschenwerk ist dabei 2-20µm dick und besteht aus einer extrazellulären Matrix mit integrierten Trabekelmaschenwerkszellen. Veränderungen der Zellen (etwa deren Aktin-Zytoskelette) sind über Signalkaskaden (z.B. Integrin-Kaskade) eng mit dem Zustand der extrazellulären Matrix verknüpft und vice versa. Unterschiedliche Einflussfaktoren können somit zum Remodelling der Extrazellularmatrix mit Veränderung der Abflussfazilität und folglich Veränderung der Augeninnendruckregulation führen.
 Klinischer Hintergrund
Klinischer Hintergrund
In das Auge eingebrachte Substanzen können je nach deren physikalischen und pharmakologischen Eigenschaften unterschiedliche Effekte auf die Zirkulation des Kammerwassers ausüben und dadurch zu Druckveränderungen führen oder auch toxische Auswirkungen auf die Zellen des Kammerwinkels besitzen. Somit können Substanzen und Implantate anhand dieses Modells, bevor sie am Menschen verwendet werden, vorab auf deren Biokompatibilität und möglichen Einfluss auf die Kurzzeitvarianz des Augeninnendruckes untersucht werden. Zusätzlich versuchen wir mit diesem Tierersatzmodell einen Betrag zur Vermeidung von Tierversuchen zu leisten.
Abbildung: Aufbau des modifizierten Vorderkammermodelles unter Laborbedingungen im Inkubator mit zusätzlicher Perfusion mit einem Nährmedium.
Warum sind bestehende Standardtherapien nicht ausreichend?
In vivo ist die kontrollierte Identifizierung eines einzigen Einflussfaktors bzw. der Effekt einer einzelnen Substanz auf das Auge und den Bereich des Kammerwinkels nur schwer möglich. Meist handelt es sich um eine Kombination unterschiedlicher Einflussfaktoren, die durch unterschiedliche Operationsverfahren, mehrere eingesetzte Substanzen und individuell verschiedene Gegebenheiten zu einem multifaktoriellen Verlauf führen.
Zielsetzung
Im Rahmen eines standardisierten Modells untersuchen wir gezielt den Verlauf des Augeninnendruckes unter kontrollierten Bedingungen gezielt. Zusätzlich erfolgt je nach Untersuchung im Anschluss eine Evaluierung der Biokompatibilität mittels histologischer Auswertung mit unterschiedlichen Färbungen, um zusätzlich zur Druckentwicklung etwaig toxische Effekte und Einflussgrößen auf den Kammerwinkel zu identifizieren.
Wie ist der Projektstand?
Nach der Etablierung der Versuchsmethode erfolgt die Testung unterschiedlicher Substanzen und deren Einfluss auf die Kurzzeitvariabilität des Augeninnendruckes. Es wurden bereits unterschiedliche Endotamponaden sowie Glaskörperersatzsubstanzen auf deren postoperative Druckentwicklung und deren Biokompatibilität untersucht. Ebenso arbeiten wir stetig an weiteren Optimierungsmöglichkeiten des Modells um ein breiteres Einsatzgebiet als Tierersatzmodell zu erreichen.
Arbeitsgruppenleiter
Prof. Dr. med. Kai Januschowski
Dr. med. Anna-Maria Seuthe
iManage Amblyopia
Projekt-Zusammenfassung
Gesamtziel des Verbundprojekts ist eine interaktive und kontextsensitive Shutterbrille mit sensorischem Feedback zur individualisierten Therapie von Schwachsichtigkeit bei Kindern, die über eine inter-aktive, benutzerfreundliche App für Smartphone und Tablet die Familie des kindlichen Patienten sowie das behandelnde medizinische Fachpersonal in die Verlaufskontrolle und Therapieoptimierung miteinbezieht. Wir streben an, mit diesem körpernahen Medizinsystem die durchschnittliche Tragezeit im Vergleich zur derzeitigen Situation mindestens zu verdoppeln und durch die erhöhte Therapieadhärenz die Zahl der erfolgreichen Therapien deutlich zu erhöhen.
Wussten Sie schon?
Die Amblyopie stellt weltweit eine der häufigsten kindlichen Sehstörungen dar. Die häufigsten Ursachen für die Entwicklung einer Amblyopie sind Refraktionsfehler (Kurz-, Weit- oder Stabsichtigkeit) und Schielfehlstellungen. In der sogenannten „sensitiven Phase“ des Sehens, die bis zum 7. Lebensjahr andauert, reagiert das visuelle System sehr empfindlich auf die Unterdrückung des Seheindruckes. Die Therapie sollte deshalb frühzeitig, also vor dem 7. Lebensjahr begonnen werden, da die Amblyopie in der Entwicklungsphase des Sehens vollständig oder zumindest teilweise reversibel ist.
 Klinischer Hintergrund
Klinischer Hintergrund
Mit einer Prävalenz von 3–5% bildet Schwachsichtigkeit, auch Amblyopie genannt (griech.: stumpfe Sicht), eine der häufigsten Ursachen für Sehbehinderungen während der ersten Lebensjahre. Es handelt sich dabei um eine Unterentwicklung desjenigen Teils des Nervensystems, das für die Verarbeitung visueller Information erforderlich ist. Die Erkrankung kann sich insofern verhängnisvoll auswirken, als sich das lebenslange Risiko einer Erblindung beidseits infolge Erkrankung bzw. Traumatisierung auch des gesunden Auges nahezu verdreifacht. Ursächlich finden sich häufig zunächst organisch bedingte Sehbehinderungen im frühen Kindesalter, wie ein- oder beidseitiger Refraktionsfehler, Schielen oder eine frühkindliche Katarakt. Nach bestmöglicher Korrektur der organischen Ursachen wird die Amblyopie bisher standardmäßig durch Okklusion des besseren Auges mit einem verdunkelnden Pflaster therapiert, wobei der Therapieerfolg von der Okklusionstragezeit abhängt. Als Alternative wird derzeit, mit vielversprechenden Studienergebnissen, auch eine modische elektronische „Shutterbrille“ mit einem LCD-Brillenglas verwendet, mit der das bessere Auge durch Opazifizierung des Brillenglases rhythmisch im 30-Sekunden-Takt okkludiert wird.
Warum sind bestehende Standardtherapien nicht ausreichend?
Die eigentliche Herausforderung in der Therapie besteht per se darin, dass die Therapieadhärenz, insbesondere beim Verdecken des gut sehenden Auges mit einem unbequemen, entstellenden und daher vom Kind schlecht akzeptierten Klebepflaster, sehr unbefriedigend ist. Auch mit den modernen Shutterbrillen ist die Therapieadhärenz, wenngleich besser, häufig noch nicht hinreichend, weshalb unnötig viele Therapien versagen.
Zielsetzung
Bei der im Vorhaben anvisierten interaktiven Shutterbrille handelt es sich um ein unmittelbar am Körper getragenes medizintechnisches System. Die Brille steht in direkter Interaktion mit dem kindlichen Nutzer, indem sie diesem ein direktes, sensorbasiertes Feedback übermittelt und damit sofortige Korrekturmaßnahmen ermöglicht. Eltern und medizinischem Fachpersonal wird täglich ein gebündeltes Feedback bereitgestellt, so dass längerfristig nachhaltige Korrekturmaßnahmen eingeleitet werden können. Außerdem wird die Therapie kontextsensitiv an die jeweilige Situation angepasst. Wir erwarten uns eine deutlich höhere Therapieadhärenz und damit eine bessere Patientenversorgung, wenn das Kind bei falsch sitzender oder abgesetzter Brille durch unmittelbares kindgerechtes Feedback zur Korrektur des Brillensitzes bzw. zum Aufsetzen der Brille motiviert wird, und zusätzlich das Trageverhalten sowie die Zeiten effektiver Okklusion täglich an Eltern und medizinisches Fachpersonal übermittelt und damit überwacht werden können. Die gewonnenen Daten werden darüber hinaus für eine wissenschaftliche Auswertung der Therapie-Compliance eines größeren Patientenkollektivs herangezogen. Die bereits qualitativ festgestellte Dosis-Wirkungsbeziehung ließe sich erstmals wissenschaftlich fundiert quantifizieren.
Wird die Shutterbrille zusätzlich mit Sensorik ausgestattet, lässt sich deren Okklusionsverhalten, abhängig vom jeweiligen situativen Kontext, auch aktiv steuern: Geringe körperliche Aktivität des Kindes erlaubt eine maximale Okklusionsdauer des gesunden Auges zwecks Optimierung des Trainingseffekts für das schwachsichtige Auge, während bei sportlicher Aktivität die Okklusion ausgesetzt werden sollte, um Unfälle aufgrund des sonst fehlenden räumlichen Sehvermögens zu vermeiden.
Wie ist der Projektstand?
Das Vorhaben bekam ein positives BMBF-Votum in der Kategorie „Systemische Umsetzungen und Interaktionskonzepte für eine bessere Handhabung körpernaher Medizintechniksysteme“. Ein Start für die Entwicklung ist mit allen Kooperationspartner, Fraunhofer-Institut für Biomedizinische Technik IBMT und Novidion GmbH, ab April 2017 geplant.
Das Projektteam
Prof. Dr. med. Kai Januschowski (Arbeitsgruppenleiter)
Dr. med. Annekatrin Rickmann (Arbeitsgruppenleiterin)
Prof. Dr. med. Gesine Szurman
Caroline Emmerich
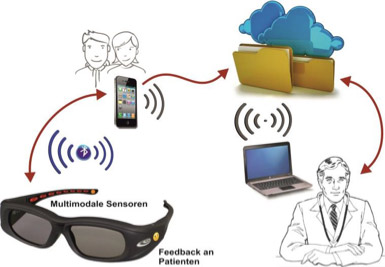 Abbildung: Darstellung des InsisT-Systems. Die mit multimodalen Sensoren und Patientenfeedback ausgestattete Shutterbrille kommuniziert über eine Bluetooth-Schnittstelle bidirektional mit einem Smartphone, wobei die zugehörige Software von den Eltern des Kindes intuitiv bedienbar ist. Das Smartphone übermittelt relevante Daten an eine über das Internet zugängliche Patientenakte, die vom behandelnden Arzt über eine Internetschnittstelle abgerufen und ausgewertet werden kann.
Abbildung: Darstellung des InsisT-Systems. Die mit multimodalen Sensoren und Patientenfeedback ausgestattete Shutterbrille kommuniziert über eine Bluetooth-Schnittstelle bidirektional mit einem Smartphone, wobei die zugehörige Software von den Eltern des Kindes intuitiv bedienbar ist. Das Smartphone übermittelt relevante Daten an eine über das Internet zugängliche Patientenakte, die vom behandelnden Arzt über eine Internetschnittstelle abgerufen und ausgewertet werden kann.
Publikationen
Januschowski K., Bechtold T. E., Schott T. C., Huelber-Januschowski M. S., Blumenstock G., Bartz-Schmidt K. U., Besch D. and Schramm C. (2013). "Measuring wearing times of glasses and ocular patches using a thermosensor device from orthodontics." Acta ophthalmologica 91(8): e635-640.
Januschowski K, Schramm C: Amblyopietherapie im Wandel der Zeit DOG-Symposium (DO26), DOG 2016
Limitations of the TheraMon® -microsensor in monitoring occlusion therapy. Schramm C, Abaza A, Blumenstock G, Bechtold TE, Rickmann A, Bartz-Schmidt KU, Besch D, Januschowski K. Acta Ophthalmol. 2016 Dec;94(8):e753-e756. doi: 10.1111/aos.13134. Epub 2016 Jun 27. PMID: 27350046
Mehr Infos zur interaktiven Shutterbrille
www.insist-brille.de
Stammzelltherapie der Hornhaut
Projekt-Zusammenfassung
Ziel dieser Arbeitsgruppe ist die Etablierung der Isolation von Limbusstammzellen aus Spenderbulbi und der Aufbau einer Kryobank für Limbusstammzellen von HLA-typisierten Spendern, sowie deren Vermittlung. Das Projekt entsteht in einem Europäischen Kryobanking-Verbund zur Kultivierung und Vitrifikation von Limbusstammzellen auf Basis von induzierten pluripotenten Stammzellen (iPS).
Wussten Sie schon?
Die Stammzellen der Limbus corneae Region des Auges dienen als Zellreservoir für Regenerations- und Reparaturprozesse der Hornhaut. Werden diese durch Traumata oder durch Autoimmunerkrankungen zerstört, kann sich die Hornhaut nicht mehr erneuern und Bindehaut sowie Blutgefäße können ungehindert auf der Hornhaut wachsen. Das hat zur Folge, dass sich die Hornhaut eintrübt und die Betroffenen erblinden. Dem Betroffenen kann nur durch eine Transplantation von Limbusstammzellen geholfen werden.
 Klinischer Hintergrund
Klinischer Hintergrund
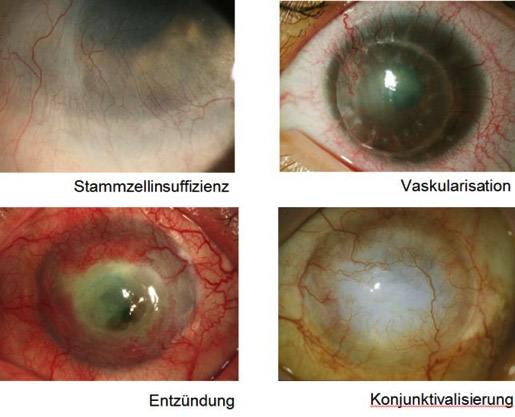
Die Stammzellen der Limbus corneae Region des Auges, die so genannten Limbusstammzellen, dienen als Zellreservoir für Regenerations- und Reparaturprozesse der Hornhaut. Werden diese durch Traumata (z.B. Verätzungen und Verbrennungen) oder durch Autoimmunerkrankungen mit Bindehaut- und Hornhautbeteiligung zerstört, führt das nicht nur dazu, dass sich die Hornhaut nicht mehr erneuern kann, Bindehaut und Blutgefäße können nun auch ungehindert auf der Hornhaut wachsen. Das hat zur Folge, dass sich die Hornhaut eintrübt und die Betroffenen erblinden. Eine herkömmliche Hornhauttransplantation reicht in diesem Falle nicht aus, da durch sie nicht die zerstörten Limbusstammzellen ersetzt werden und deswegen nach geraumer Zeit die Oberflächenzellen des Hornhauttransplantats ,,aufgebraucht’’ sind. Der Patient erblindet erneut. Das kann durch eine Transplantation von Limbusstammzellen verhindert werden. Da häufig beide Augen betroffen sind, ist eine autologe Transplantation (vom gesunden auf das kranke Auge) meist nicht möglich. Es muss ein Spender gefunden werden, der optimal zu den Gewebemerkmalen des Empfängers passt, um Abstoßungsreaktionen zu vermeiden. Dieser häufig schwierige und langwierige Prozess kann durch eine Limbusstammzellbank mit bereits HLA-typisierten Zellspenden umgangen werden.
Abbildung: Vier Gründe für eine nicht-erfolgreiche Hornhauttransplantation
Warum sind bestehende Standardtherapien nicht ausreichend?
Gegenwärtig wird eine Limbusstammzell-Insuffizienz in der Regel durch eine autologe Transplantation behandelt. Das bedeutet, dass aus einer gesunden Region im Limbus Stammzellen isoliert und kultiviert werden und in die erkrankte Limbusregion transplantiert werden. In vielen Fällen ist aber die Insuffizienz soweit fortgeschritten, dass nicht genügend gesundes Gewebe bereit steht. Diesen Patienten kann nur durch eine HLA-typisierte Zellspende geholfen werden. Im Gegensatz zu Hornhautspenden gibt es für Limbusstammzell-Spenden keine organisierten Strukturen oder gar Gewebebanken, welche Transplantate vorhalten. Daher gestaltet sich die Spendersuche im Fall von Limbusstammzellen oft schwierig und ist häufig auf die Angehörigen des Patienten beschränkt.
Zielsetzung
Schwerste Hornhauterkrankungen könnten in vielen Fällen schonend mit einer neuen Stammzell-Transplantation behandelt werden. Das Verfahren kommt bei Verätzungen, Verbrennungen und Tumoren in Frage. Wünschenswert ist der Aufbau einer Limbusstammzellbank, welche HLA-typisierte Limbusstammzellen kryokonserviert vorbehält und bei Bedarf an die Transplantationsklinik versendet. Eine Spendersuche wäre in diesem Falle überflüssig und dem betroffenen Patienten könnte umgehend geholfen werden.
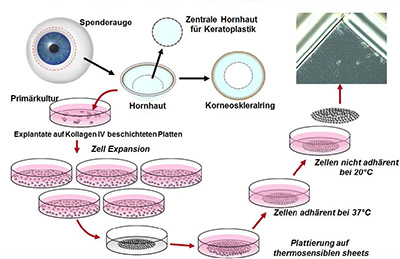 Wie ist der Projektstand?
Wie ist der Projektstand?
Im Mai 2016 wurde in Zusammenarbeit mit der Deutschen Gesellschaft für Gewebetransplantation (DGFG) die Knappschafts-Gewebebank Sulzbach (HSB) eröffnet. Sie erhält aus dem Spendernetzwerk der DGFG humane Spenderbulbi zur Herstellung von Hornhauttransplantaten. Dabei bleibt die Limbusregion der Bulbi als ,,Abfall‘‘ zurück, wodurch auch viele verschiedene Limbusstammzellspenden bereit stehen. Ebenfalls wurde eine Kooperation mit dem Fraunhofer-Institut für Biomedizinische Technik IBMT in Sulzbach ins Leben gerufen, das große Erfahrung in der Kultivierung von Stammzellen und Kryokonserierung mitbringt.
Abbildung: Konzept zur Stammzellgewinnung und Ex-Vivo-Expansion
Das Projektteam
Dr. rer. nat. Silke Wahl (Arbeitsgruppenleiter)
Dr. med. Annekatrin Rickmann
Prof. Dr. med. Peter Szurman