Tissue Engineering
- Details
- Zugriffe: 7326
Projekt-Zusammenfassung
Ziel dieser Arbeitsgruppe ist die Entwicklung von künstlichen Geweben und Biogrenzflächen, welche sowohl das Verständnis als auch die Therapie von Augenkrankheiten mit dem Schwerpunkt vitreoretinale und korneale Krankheitsbilder fördern sollen.
Klinischer Hintergrund
In den frühen 1990er Jahren entstand mit dem Tissue Engineering (engl. für Gewebezüchtung) ein interdisziplinärer Teilbereich der regenerativen Medizin, der darauf abzielt, die Funktion eines biologischen Gewebes wiederherzustellen, zu erhalten oder zu verbessern. Durch die gezielte Kombination von Zellen und bioaktiven Stoffen (z.B. Wachstumsfaktoren) mit einem Biomaterial als strukturellem Gerüst können künstliche Gewebe entstehen, die sich nach der Implantation im menschlichen Körper integrieren und den Heilungsprozess fördern. Das Auge bietet mit seinen unterschiedlichen Strukturen, Zelltypen und Geweben eine Vielzahl Tissue-Engineering-relevanter Herausforderungen. Aufgrund altersbedingter Degenerationsprozesse und verschiedener Krankheitsverläufe kann es zu auftretenden Fehlfunktionen des okularen Gewebes mit dem Risiko von schweren Sehbehinderungen bis hin zur Erblindung kommen. Einen geeigneten Therapieansatz stellt die Transplantation von natürlichen (Teil-)Geweben oder artifiziellen Ersatzstoffen dar.
In der Augenheilkunde besteht insbesondere ein hoher Bedarf an geeigneten Ersatzmaterialien für die Hornhaut, die Linse und den Glaskörper. Bei der Hornhauttransplantation werden beschädigte oder erkrankte Hornhäute durch gespendetes Hornhautgewebe ganz (perforierende Keratoplastik) oder teilweise (lamellare Keratoplastik) ersetzt. Hinzu kommen über 20 Mio. Katarakt-Operationen weltweit, bei der die getrübte Linse abgesaugt und durch eine starre Kunstlinse ersetzt wird. Nicht zuletzt erfordert die Therapie von komplizierten Netzhaut- und Glaskörpererkrankungen das chirurgische Entfernen des natürlichen Glaskörpers (Vitrektomie) und einen geeigneten Ersatz des Gewebes.
Warum sind bestehende Standardtherapien nicht ausreichend?
Eine der größten Herausforderungen, vor der das Tissue Engineering bis heute steht, ist die notwendige komplexe Funktionalität eines Gewebes und dessen gezielte Integration in den menschlichen Körper. Die Anfänge der regenerativen Medizin zeigten, dass der Einsatz von rein synthetischen Materialien häufig mit der Gefahr von Fremdkörperreaktionen verbunden war, die zu beschwerlichem Implantat-Versagen sowie zu Entzündungs- und Abstoßungsreaktionen führten. Die gestörten Wundheilungsprozesse und Infektionen können zudem zur Ausbildung von Narben führen, die die Sehfähigkeit einschränken. Um die Verträglichkeit der Implantate zu verbessern, gewannen zunehmend Konzepte an Bedeutung, die bioaktive oder körpereigene Materialien integrierten. So sollen Biomaterialien und lebende Zellen die Biokompatibilität, Funktionalität und Stabilität des Implantats erhöhen und dessen erfolgreichen Einsatz zur Regeneration von Körperfunktionen langfristig sichern.
Trotz der medizinischen Fortschritte der letzten Jahre verdeutlichen der Anstieg der altersbedingten Erblindungen und der bestehende Mangel an Gewebespenden den Bedarf an alternativen Behandlungsmethoden. Am Beispiel der Hornhauttransplantationen ist die Zahl der geeigneten Transplantate durch Faktoren wie Vernarbungen und geringe Endothelzellzahlen, Haltbarkeit und positive virologische oder mikrobiologische Befunde der Transplantate limitiert. Bestehende Ansätze zur Entwicklung von künstlichen Hornhautgeweben sind zum einen durch die mangelnde Bioverträglichkeit, Geometrie und Stabilität der Gerüststrukturen und zum anderen durch die ungenügende Integration und Funktionalität der verschiedenen Hornhautzellen eingeschränkt. Mit Blick auf die Behandlung eines Katarakts ist zu beanstanden, dass bei einer Graue-Star-Operation zwar die Sehkraft wiederhergestellt wird, jedoch nicht die Akkomodation (Naheinstellung). Zusätzlich muss eine Vielzahl der behandelten Patienten aufgrund einer proliferierenden, trüben Zellschicht hinter dem Linsenimplantat (Nachstar) für eine zweite Operation vorstellig werden. Auch die bestehenden Ersatzstrategien für den entfernten, natürlichen Glaskörper nach Netzhaut- und Glaskörperoperationen sind durch den Einsatz von hydrophoben Ölen, Gasen oder Perfluorcarbenen unzureichend, da Komplikationen wie Emulsifikationen, Kataraktbildung und die Notwendigkeit einer zusätzlichen operativen Entfernung resultieren können.
Zielsetzung
Durch die Kombination von Zellen, Biomaterialien und bioaktiven Stoffen wie Wachstums- und Differenzierungsfaktoren sollen mit Blick auf die klinische Anwendung gezielt neue regenerative Behandlungsstrategien entwickelt werden:
- Entwicklung der weltweit ersten Tamponade für die Netzhautchirurgie auf Basis eines Hydrogels, welche die natürlichen Eigenschaften des gesunden Glaskörpers nachbildet. Der aktuelle materialbasierte Entwicklungsstand soll durch Inklusion von Zellen und/oder Zellprodukten um die Ebene des Tissue Engineerings erweitert werden.
- Entwicklung einer echten akkommodierenden Linse auf Basis eines flexiblen biokompatiblen Hydrogels, mit dem der Kapselsack nach Femtosekunden-laser-gestützter Linsenentfernung wieder aufgefüllt werden soll.
- Entwicklung eines transplantierbaren bioresorbierbaren Trägersheets mit kultivierten autologen oder hiPSC-abgeleiteten Limbusstammzellen zur Behandlung von Patienten mit Hornhautblindheit aufgrund schwerster Verbrennungen/Verätzungen.
- Entwicklung eines dreidimensionalen künstlichen Hornhautkonstrukts mit Rezellularisierung durch autologe oder hiPS-abgeleitete Hornhautzellen sowie die Optimierung der Präparations- und Kultivierungstechniken für künstliche Biomatrix-Konstrukte im Vergleich zu modifizierten Hornhaut-Spenderlamellen.
Über den Erhalt bzw. die Rückgewinnung von funktionellem Gewebe hinausgehend wird darauf abgezielt, das Risiko potentieller Abstoßungs- und Entzündungsreaktionen nach Transplantation zu reduzieren und den Therapieerfolg eines Transplantats langfristig zu sichern. Dazu ist es notwendig, die Biogrenzfläche mit ihren vielfältigen Zell-Matrix-Interaktionen in den fächerübergreifenden Fokus von Medizin, Biologie, Chemie und Materialwissenschaften zu rücken. Das Design von künstlichen Geweben und definierten Biogrenzflächen erfordert dabei ein tiefes Verständnis der komplexen Wechselwirkungen zwischen Material und Zelle, das unter Laborbedingungen außerhalb des Organismus -in-vitro- erlangt werden kann.
Wie ist der Projektstand?
Es besteht langjährige Erfahrung mit der Entwicklung biopolymerer Materialplattformen, insbesondere von Hydrogel-basierten Gerüststrukturen, sowie der Isolation, Kultivierung und Manipulation verschiedenster Zellen für das Tissue Engineering. Kritische Materialeigenschaften zur Herstellung biomimetischer Systeme wurden definiert und tiefergehend untersucht. Studien zum Einfluss der Materialoberfläche und von Proteinen auf die Biogrenzfläche lieferten Erkenntnisse zur gezielten Kontrolle und Steuerung von Zellfunktionen. In in-vitro-Studien wurden erste, vielversprechende Materialsysteme getestet, mit Zellen besiedelt und die resultierenden Zell-Matrix-Kontakte analysiert. Die Evaluation der Prototypen in-vivo wird zur Zeit weiter vorangetrieben.

- Extraktion und Präparation von Geweben
- Toxizitäts-Assays
- Synthese und Modifikation artifizieller Gerüststrukturen
- Biochemische Dezellularisierung von tierischem Gewebe
- Bestimmung physikochemischer Materialeigenschaften (Benetzbarkeit, Ladung, Rauigkeit, Topografie, Stabilität/Degradation, Porosität, rheologische und mechanische Charakteristika)
- Analyse der Proteinadsorption (Quantität, Stabilität, Faltungsprozesse)
- Zellkulturtechniken mit Adhäsions-, Proliferations-, Migrations- und Differenzierungs-Assays
- Histologische Gewebsschnitte
- Molekularbiologische Assays (qPCR)
- Immunologische Methoden (ELISA, Immunfluoreszenz, FACS, Western Blot)
- Vitreoretinale Operationseinheit (Funduskopie, OCT, Augendruckmessung)
- Elektrophysiologische Untersuchungseinheit (ERG)
Das Projektteam
Dr. rer. nat. André Schulz (Arbeitsgruppenleiter)
Dr. med. Annekatrin Rickmann
Dr. rer. nat. Silke Wahl
Dr. rer. nat. Henrike Julich-Härtel
Prof. Dr. med. Kai Januschowski
Prof. Dr. med. Peter Szurman
Kooperationspartner
Fraunhofer-Institut für Biomedizinische Technik IBMT
Schlüsselpublikationen
-
- Schulz A, Rickmann A, Wahl S, Germann A, Stanzel B V, Januschowski K, Szurman P (2020). Alginate-and hyaluronic acid–based hydrogels as vitreous substitutes: An in vitro evaluation. Transl. Vis. Sci. Techn., 9(13): 34.
- Schulz A, Rickmann A, Julich‐Haertel H, Germann A, von Briesen H, Januschowski K, Szurman P (2020). Comparative cytotoxic and antiproliferative profile of methotrexate and fluorouracil on different ocular cells. Acta Ophthalmologica.
- Schulz A, Wahl S, Rickmann A, Ludwig J, Stanzel BV, von Briesen H, Szurman P (2019): Age-related loss of human vitreal viscoelasticity. Transl. Vis. Sci. Techn., 8(3): 56.
- Schramm C, Spitzer MS, Henke-Fahle S, Steinmetz G, Januschowski K, Heiduschka P, Geis-Gerstorfer J, Biedermann T, Bartz-Schmidt KU, Szurman P (2012): The crosslinked biopolymer hyaluronic acid as an artificial vitreous substitute. Invest Ophth Vis Sci, 53 (2), 613-621.
- Schulz A, Gepp MM, Stracke F, von Briesen H, Neubauer JC, Zimmermann H (2019): Tyramine-conjugated alginate surfaces as a platform for bioactive scaffolds. J. Biomed. Mater. Res. A., 107(1): 114-121.
- Schulz A, Katsen-Globa A, Huber EJ, Mueller SC, Kreiner A, Pütz N, Gepp MM, Fischer B, Stracke F, von Briesen H, Neubauer JC, Zimmermann H (2018): Poly(amidoamine)-alginate hydrogels: Directing the behavior of mesenchymal stem cells with charged hydrogel surfaces. J. Mater. Sci. Mater. Med., 29: 105.
- Yoeruek E, Bayyoud T, Maurus C, Homann J, Spitzer MS, Bartz-Schmidt KU, Szurman P (2012): Decellularization of porcine corneas and repopulation with human corneal cells for tissue-engineered xenografts. Acta Ophthalmologica, 90(2): 125-131.
Superfundiertes isoliertes Netzhautmodell
- Details
- Zugriffe: 7470
Projekt-Zusammenfassung
Ziel dieser Arbeitsgruppe ist die elektrophysiologische Untersuchung isolierter Retinakulturen während und nach der Umspülung mit einer Testsubstanz zur Detektion etwaig retinatoxischer Effekte. Hierzu konnten wir ein Organmodell der isolierten superfundierten Netzhautpräparaten aufbauen. Das erlaubt ein in-vivo Monitoring der Netzhautfunktion unter definierter Exposition von zu testenden Wirkstoffen über einen Zeitraum von 36 Stunden. Somit wird ein direktes Monitoring substanzspezifischer Einflüsse auf die Netzhautfunktion ermöglicht. Zusätzlich besteht eine zellbiologische Laborstruktur, die eine standardisierte Bestimmung der selektiven Medikamententoxizität an kultivierten retinalen Zelllinien erlaubt. Seit Bestehen der Arbeitsgruppe haben wir grundlegende Erkenntnisse zum medikamentösen Targeting retinaler Erkrankungen erzielt und damit die klinische Sicherheit neu eingeführter Medikamente verbessert.
Netzhaut - Anatomie & Physiologie
Die Netzhaut befindet sich im hinteren Teil des Auges, in dem die Lichtrezeptoren liegen und die ersten Informationen über das Sehen verarbeitet werden. Sie ist, wie das Gehirn, durch die sogenannte Blut-Retina-Schranke vom restlichen Organismus getrennt.
Als erste Schicht, die das Licht verarbeitet, sind die Photorezeptoren (Stäbchen und Zapfen) zu nennen. Danach schließt sich die äußere plexiforme Schicht an, in der die Fortsätze der Photorezeptoren synaptisch mit den Horizontal- und Bipolarzellen verschaltet sind, die mit den Zellkörpern der Amakrinenzellen die innere Körnerschicht bilden. Weiter nach Innen schließt sich die innere plexiforme Schicht an, in der die Synapsenkontakte der amakrinen Zellen und die der Bipolarzellen mit den Ganglienzellen zu treffen sind. Aus den Axonen der Ganglienzellen wird die Ganglienzellfaserschicht gebildet, die als Nervus opticus zur Sehrinde ziehen. Die Müllerstützzellen bilden die Lamina limitans externa und die Lamina limitans interna.
Die Reiztransduktion in der Netzhaut ist für die Wahrnehmung visueller Reize essentiell und kann zugleich durch Ableitung eines ERGs gemessen werden. Das besondere an den Sinnesrezeptoren der Retina ist, dass Sie im Ruhezustand depolarisiert und im Erregungszustand hyperpolarisiert sind.
Bei anderen neuronalen Mechanismen der Reizverarbeitung im Körper ist das Gegenteil der Fall. Diese Hyperpolarisation ist im ERG messbar.
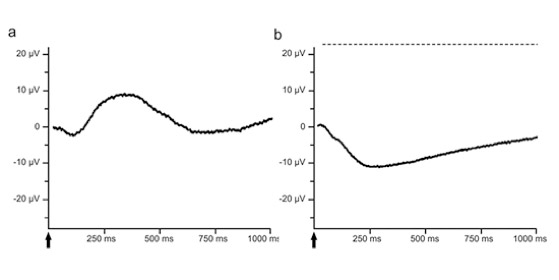
a: Antwort des Photorezeptors im zeitlichen Verlauf dargestellt. Der Lichtreiz ist durch den Pfeil markiert
b: Antwort des höheren neuronalen Netzwerkes im zeitlichen Verlauf dargestellt. Der Lichtreiz ist durch den Pfeil markiert.
Klinischer Hintergrund
Während der Behandlung von Netzhaut- und Glaskörpererkrankungen kommt die Netzhaut nach der Entfernung des natürlichen Glaskörpers (Vitrektomie) mit unterschiedlichen Substanzen in Kontakt. Je nach Krankheitsbild kann auch eine (temporäre) Endotamponade über längere Zeit nach der Operation in der Glaskörperkavität verbleibend. Hierfür müssen diese Substanzen gewisse Voraussetzungen erfüllen. Mithilfe der superfundierten Netzhaut ist es möglich eine potentielle Retinatoxizität vorab zu testen.
Warum sind bestehende Standardtherapien nicht ausreichend?
Aktuell ist es in vitro und in vivo nur leidlich möglich, eine standardisierte Beziehung zwischen Dosis, Applikationszeit und retinaler Toxizität herzustellen. Ein echter in vitro Ansatz ist derzeit aufgrund des komplexen Aufbaus der Retina und deren Störanfälligkeit sowie der fehlenden Perfusion nicht praktikabel.
Zielsetzung
Um den Einsatz von Tierversuchen zu minimieren, verfolgen wir mit der superfundierten Netzhaut einen ex-vivo Ansatz. Hierbei wird eine bovine Netzhaut mit einer Nährlösung und der zu testenden Substanz umspült und im Anschluss eine elektrophysiologische Untersuchungen durchgeführt. Je nach dem Muster der retinalen Antwort auf einen Lichtreiz kann somit auf eine mögliche Retinatoxizität der Substanz geschlossen werden.
So funktioniert das ERG (Elektroretinographie)
Das ERG wurde erstmalig 1849 von Du-Bois-Raymond am Bulbus eines enukleierten Fischauges abgeleitet. Bereits 1945 wurde das ERG klinisch nutzbar gemacht.
Heute ist es der Goldstandard zur Diagnostik bei Netzhautdegenerationserkrankungen oder -dystrophien. Bei einem ERG kann man zwei Wellenkomponenten unterscheiden, eine a-Welle (Hyperpolarisation) und eine b-Welle (Depolarisation). Die a-Welle liefert Informationen über die Funktionalität der Lichtrezeptoren der Netzhaut (Abb. a). Sie ist das durch die Photorezeptoren gebildete Summenpotential, die als erste Antwort auf einen Lichtreiz in Form eines negativen Ausschlags im ERG erscheint. Auf diesen ersten negativen Ausschlag folgt mit einer kurzen Latenz ein positiver Ausschlag, die b-Welle. Von der b-Welle im ERG zieht man Rückschlüsse auf die Funktion der höheren neuronalen Netzwerke innerhalb der Netzhaut (Abb. b). Das Zusammenspiel mehrerer Zelltypen generiert die b-Welle. Sie ist damit als Indikator für die komplexen, integrierenden Netzwerkfunktionen sehr sensibel.
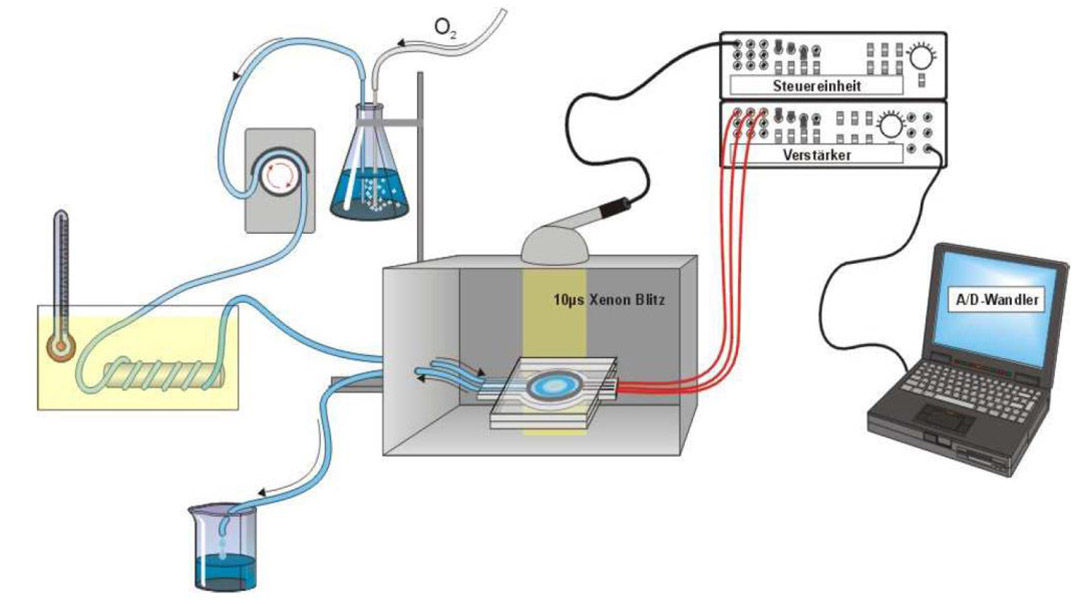
Messung der Retinalen Biokompatibilität
Durch unterschiedliche Reizintensitäten oder durch Zugabe von Aspartat zur Nährlösung können wir die Antwort der Photorezeptoren proportional stärker darstellen oder vollständig isolieren.
Damit lässt sich das Wirkverhalten wie auch der Wirkort verschiedener Substanzen auf die einzelnen Neuronenschichten untersuchen. Wird z.B. eine Verminderung der b-Welle unter Exposition eines Wirkstoffs beobachtet, so kann das an einer Schädigung der Photorezeptoren liegen, die sich dann indirekt auf die Amplitude der b-Welle auswirkt - oder an den Zelltypen, die die b-Welle erzeugen. Mithilfe der separaten Untersuchung von a- und b-Welle können wir das differenzieren. Mit dem ERG hat man ideale Ausgangsbedingungen, um hoch standardisierte Biokompatibiltiätsstudien an einem Organkulturmodel durchzuführen.
Wie ist der Projektstand?
Nach der Etablierung des experimentellen Aufbaus in den letzten Jahren erfolgt nun die kontinuierliche Verfeinerung und Optimierung der Untersuchungsmethode. Die zuverlässige Detektion sowie die präzise Messbarkeit eines möglichen retinatoxischen Effektes konnten wir bereits anhand mehrerer zu untersuchender Substanzen zeigen.
Das Projektteam
Prof. Dr. med. Kai Januschowski (Arbeitsgruppenleiter)
Loic Sermeus
Publikationen
- Januschowski K, Mueller S, Dollinger R, Schnichels S, Hofmann J, Spitzer MS, Bartz-Schmidt KU, Szurman P, Thaler S. Investigating retinal toxicity of tempol in a model of isolated and perfused bovine retina. Graefes Arch Clin Exp Ophthalmol. 2014 Jun;252(6):935-41. doi: 10.1007/s00417-014-2632-4. Epub 2014 May 2. PMID: 24789463
- Januschowski K, Schnichels S, Hagemann U, Koch V, Hofmann J, Spitzer MS, Bartz-Schmidt KU, Szurman P, Lüke M, Aisenbrey S. Electrophysiological toxicity testing of VEGF Trap-Eye in an isolated perfused vertebrate retina organ culture model.Acta Ophthalmol. 2014 Jun;92(4):e305-11. doi: 10.1111/aos.12300. Epub 2013 Nov 8. PMID: 24206925
- Januschowski K, Maddani R, Mueller S, Lueke M, Spitzer MS, Schultheiss M, Bartz-Schmidt KU, Szurman P. Comparing the effects of two different irrigation solutions on an isolated perfused vertebrate retina. Ophthalmic Res. 2012
- Januschowski K, Krupp C, Mueller S, Hofmann K, Schnichels S, Hagemann U, Spitzer MS, Bartz-Schmidt KU, Aisenbrey S. Investigating short-term toxicity of melphalan in a model of an isolated and superfused bovine retina. Graefes Arch Clin Exp Ophthalmol. 2015 Sep 3. [Epub ahead of print] PMID: 26335534
- Januschowski K, Müller S, Krupp C, Spitzer MS, Hurst J, Schultheiss M, Bartz-Schmidt KU, Szurman P, Schnichels S. Glutamate and hypoxia as a stress model for the isolated perfused vertebrate retina. J Vis Exp. 2015 Mar 22;(97). doi: 10.3791/52270. PMID: 25868118
- Januschowski K, Schnichels S, Hagemann U, Koch V, Hofmann J, Spitzer MS, Bartz-Schmidt KU, Szurman P, Lüke M, Aisenbrey S.Electrophysiological toxicity testing of VEGF Trap-Eye in an isolated perfused vertebrate retina organ culture model. Acta Ophthalmol. 2014 Jun;92(4):e305-11. doi: 10.1111/aos.12300. Epub 2013 Nov 8. PMID: 24206925
Suprachoroidale Hydrogelplombe
- Details
- Zugriffe: 13123
Projekt-Zusammenfassung
Ziel ist die Entwicklung einer neuen Operationsmethode zur besonders schonenden Behandlung der Netzhautablösung mit einer resorbierbaren Aderhautplombe (AG Experimentelle Retinachirurgie).
Wussten Sie schon?
Die suprachoroidale Hydrogelplombe soll langfristig ein weitverbreitetes Verfahren zur operativen Behandlung der Netzhautablösung werden.
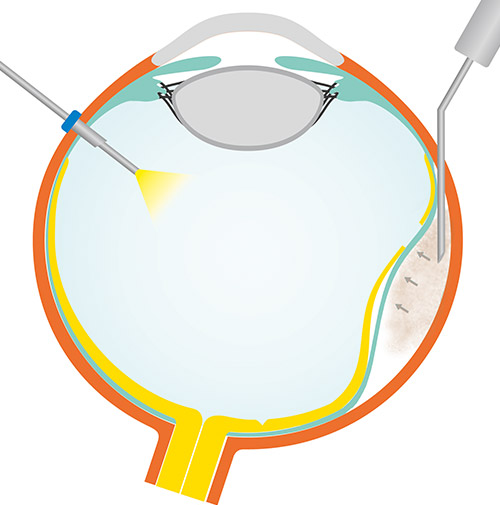 Klinischer Hintergrund
Klinischer Hintergrund
Seit Jules Gonin beruht die Behandlung der Netzhautablösung auf dem Prinzip der Identifikation und des Verschlusses des zugrundeliegenden Netzhautforamens. Sowohl die Buckelchirurgie als auch die Vitrektomie sind hierzu etablierte Verfahren. So unterschiedlich die chirurgischen Ansätze auf den ersten Blick erscheinen, so folgen sie doch beide dem von Custodis 1953 beschriebenen Prinzip der Approximation und Fixation. Entweder geschieht die Approximation und Fixation durch Aufnähen einer skleralen eindellenden Plombe und Fixation mit Kryokoagulation, oder durch eine Vitrektomie mit Approximation durch eine Endotamponade und Fixation durch eine Laserretinopexie.
Warum sind bestehende Standardtherapien nicht ausreichend?
Beide Techniken haben ihre Vor- und Nachteile: Die Buckelchirurgie hat den großen Vorteil der linsenerhaltenden Chirurgie, ist aber technisch veraltet: Sie ist limitiert durch die Verwendung der detailarmen indirekten Ophthalmoskopie, der schlechteren indirekten Illumination und der invasiveren Kryokoagulation. Damit partizipiert sie nicht an den technologischen Errungenschaften, die die moderne Vitrektomie auszeichnen und wird dadurch immer weiter aus der klinischen Routine verdrängt. Umgekehrt profitiert die Vitrektomie von der hochauflösenden Visualisierung mit Weitwinkellupensystemen und hoher Vergrößerung am modernen Mikroskop. Die effektive Endoillumination und schonende Endolaserkoagulation sind weitere Vorteile der Vitrektomie, die zu der hohen Erfolgsrate auch bei schwierigen Ausgangssituationen geführt haben. Allerdings hat die Vitrektomie den großen Nachteil der Notwendigkeit einer Endo-Tamponade mit daraus folgender progressiver Kataraktentwicklung, einer temporären Visusminderung und sonstige Problemen, wie Druckschwankungen als Folge der Tamponade.
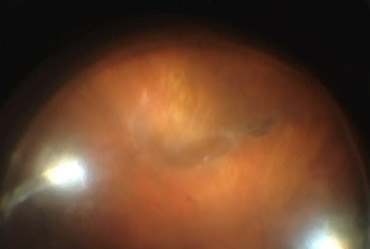 Zielsetzung
Zielsetzung
Die suprachoridale Hydrogelplombe soll das Beste aus beiden Welten kombinieren: Die Vorteile der linsenerhaltenden Buckelchirurgie mit gezielter Tamponade des Foramens von außen, aber gleichzeitig die Verwendung der modernen ophthalmochirurgischen Techniken mit Weitwinkelvisualisierung, Endoillumitation und Endolaser. Zusätzlich besteht der Anspruch an eine solche minimal-invasive Technik, dass sie einfach und schnell durchführbar ist, ohne eine großflächige Peritomie der Bindehaut auskommt, buckelassoziierte Probleme wie postoperative Doppelbilder oder eventuelle Plombendurchwanderung vermeidet. Insbesondere Lochsituationen im Bereich der Augenmuskeln sollten diese nicht mechanisch kompromittieren oder zu intraoperativen Schwierigkeiten führen.
Abbildung: Buckeleffekt der Hydrogelplombe intraoperativ
Wie ist der Projektstand?
Die suprachoroidale Hydrogelplombe konnte erstmals 2015 als neues, einfaches und sicheres Verfahren zur Behandlung der Netzhautablösung vorgestellt werden. Die technischen Vorteile der modernen Vitrektomie und der klassischen Buckelchirurgie werden in diesem operativen Ansatz vereint werden. Die Technik lässt sich additiv in Kombination mit der Vitrektomie oder als „stand-alone procedure“ angewenden. Als geeignetes Tamponadematerial hat sich das quervernetzte Hydrogel mit einer Resorptionsdauer von bis zu 8 Wochen herausgestellt. Es werden noch weitere Untersuchungen mit Langzeiterfahrungen empfohlen, die zu einer weiteren Verbreitung der suprachoroidalen Hydrogelplombe als operatives Verfahren zur Behandlung der Netzhautablösung führen sollen.
Das Projektteam
Prof. Dr. med. Peter Szurman (Arbeitsgruppenleiter)
Prof. Dr. med. Kai Januschowski
PD Dr. med. Karl Boden